Углерод химические свойства. Углерод технический, его получение
§ 4.1. Общая характеристика элементов подгруппы углерода
К химическим элементам главной подгруппы IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. В ряду C - Si - Ge - Sn - Pb из-за различной химической природы элементов их разбивают на две подгруппы: углерод и кремний составляют подгруппу углерода , германий, олово, свинец - подгруппу германия .
Электронные конфигурации внешнего слоя атомов элементов ns 2 np 2 , в соединениях они могут проявлять степени окисления от –4 до +4. Как и в главной подгруппе V группы, наблюдается изменение химических свойств элементов: углерод и кремний проявляют свойства типичных неметаллов, для германия характерны переходные свойства, а олово и свинец - типичные металлы. С увеличением атомного номера в подгруппе уменьшается электроотрицательность элементов. Для углерода и кремния характерны ковалентные соединения, для олова и свинца - ионные.
Некоторые свойства элементов главной подгруппы IV группы представлены в табл. 4.1.
Таблица 4.1
Свойства
элементов
подгруппы углерода и простых веществ
Атомный номер | Название, символ | Радиус атома, нм | Потенциал
ионизации, | ЭО | Степе ни | r , | t
пл
, | t
кип
, |
Углерод C | 0,077 | 11,3 | 2,55 | –4, 0, +2, +4 | 3,52 алмаз 2,27 графит | 3730 | 4830 |
|
Кремний Si | 0,117 | 8,2 | 1,90 | –4, 0, +2, +4 | 2,33 | 1410 | 2680 |
|
Германий Ge | 0,122 | 7,9 | 2,01 | –4, 0, +2, +4 | 5,33 | 937 | 2830 |
|
Олово Sn | 0,142 | 7,3 | 1,96 | –4, 0, +2, +4 | 7,29 | 232 | 2270 |
|
Свинец Pb | 0,154 | 7,4 | 2,33 | 0, +2, +4 | 11,3 | 327 | 1730 |
Данные табл. 4.1 подтверждают, что в ряду C - Si - Ge - Sn - Pb наблюдается монотонное изменение свойств от неметаллических к металлическим. Это проявляется в уменьшении устойчивости соединений элементов в высшей степени окисления +4 и возрастании стабильности соединений элементов в низкой степени окисления +2. Для C, Si и Ge не характерно образование свободных катионов, Sn и Pb легко образуют катионы Sn 2+ и Pb 2+ .
Об усилении металлических свойств свидетельствует изменение кислотно-основных свойств оксидов и гидроксидов элементов в степени окисления +4 при переходе от углерода к свинцу:
CO 2 | SiO 2 | GeO 2 | SnO 2 PbO 2 |
кислотные свойства | слабо | амфотерные свойства | амфотерные
свойства |
Кислотные свойства соответствующих гидроксидов изменяются аналогично.
В ряду от углерода до свинца усиливается устойчивость оксидов элементов в степени окисления +2.
Углерод существует в природе в виде двух устойчивых изотопов: 12 C (98,9%) и 13 C (1,1%).
Большое значение имеет b -радиоактивный изотоп углерода 14 C. В основе радиоуглеродного метода определения возраста углеродсодержащих пород лежит вычисление соотношения долей стабильных и радиоактивного изотопов углерода.
Углерод занимает 11-е место по распространенности на Земле. Он встречается в атмосфере в виде CO 2 , из него образованы многие минералы и горные породы, например мел, известняк, мрамор (химическая формула которых CaCO 3), доломит (MgCO 3 · CaCO 3), малахит (CuCO 3 · Cu(OH) 2). Углерод входит в состав белков, нуклеиновых кислот, углеводов - веществ, без которых невозможна жизнь.
Почти во всех соединениях (кроме CO и SiO) углерод и кремний четырехвалентны. Атомы углерода во многих соединениях образуют цепи –C–C–. Для соединений кремния также характерна полимерная структура, но в отличие от атомов углерода атомы кремния образуют разветвленные цепи, соединяясь не друг с другом, а через кислород –Si–O–Si–.
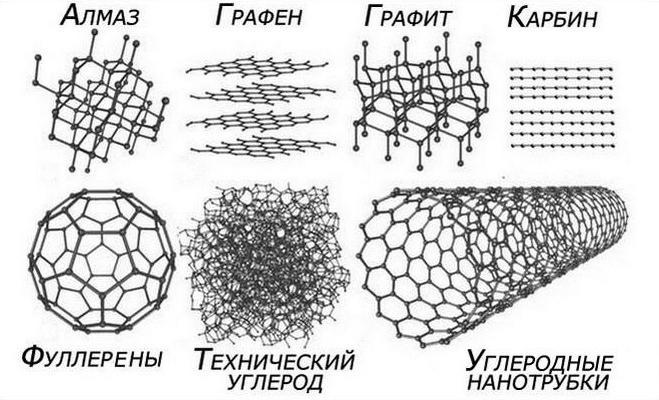
Углерод образует несколько простых веществ: алмаз, графит, карбин, фуллерен и аморфный углерод.
АЛМАЗ представляет собой бесцветные прозрачные, сильно преломляющие свет кристаллы плотностью 3,52 г/см 3 . Строение внешнего энергетического уровня атома углерода в невозбужденном состоянии описывает электронная конфигурация 2s 2 2p 2 . При образовании химических связей в атоме углерода распариваются электроны, находящиеся на s -подуровне, и он приобретает конфигурацию 2s 1 2p 3 . Орбитали четырех неспаренных электронов подвергаются sp 3 -гибридизации, приводящей к образованию четырех равноценных гибридных орбиталей, угол между которыми равен тетраэдрическому. Атомы, находящиеся в sp 3 -гибридном состоянии, и образуют структуру алмаза. Алмаз - высокопрочное вещество, имеющее уникальную твердость и отличную преломляющую способность, что важно для создания абразивных материалов, режущих инструментов и ювелирных украшений.
ГРАФИТ - это серая непрозрачная жирная на ощупь масса плотностью 2,27 г/см 3 . В графите атомы углерода находятся в sp 2 -гибридном состоянии, что обусловливает слоистую структуру графита, состоящую из плоских шестиугольников. Расстояния между атомами углерода, находящимися в разных слоях, превосходят расстояния между атомами внутри слоя. Слоистой структурой графита объясняются его электро- и теплопроводность, а также способность оставлять след на твердой поверхности. Для превращения алмаза в графит необходимо нагревание до 1800–1850 ° С без доступа воздуха. Обратный процесс идет при температуре 3000 ° С и давлении 10 6 –10 7 кПа.
Графит широко применяют в качестве электродного материала в электрохимии; он входит в состав смазок, используется в качестве замедлителя нейтронов в ядерных реакторах.
КАРБИН представляет собой кристаллический порошок черного цвета плотностью 1,9 г/см 3 . Для его получения используют реакцию дегидрирования ацетилена при 1000 ° С, в результате которой из n молекул C 2 H 2 получается полимер с линейной структурой –C º C–C º C–C º C–. В этой модификации атомы углерода находятся в sp -гибридном состоянии.
ФУЛЛЕРЕНЫ были обнаружены в продуктах конденсации паров графита. Молекула фуллерена C 60 представляет соединенные между собой пяти и шестичленные циклы, содержащие углерод в sp 2 и sp 3 – гибридном состоянии. Кроме C 60 делены фуллерены состава C 70 и C 76 .
АМОРФНЫЙ УГЛЕРОД - самая распространенная аллотропная модификация углерода. Чаще всего его получают при разложении различных органических веществ. Иногда эту форму называют древесным или активированным углем.
КРЕМНИЙ - самый распространенный после кислорода элемент в земной коре (27,6% по массе). Он имеет три стабильных изотопа: 28 Si (92,27%), 29 Si (4,68%) и 30 Si (3,05%). В природе кремний находится в виде кремнезема - оксида кремния(IV) SiO 2 (иногда его называют кварц или песок ), силикатов и алюмосиликатов , например слюды KAl 3 (OH,F) 2 , асбеста (Mg,Fe) 6 (OH) 6 , талька Mg 3 (OH) 2 . В зависимости от размеров частиц и содержания примесей в SiO 2 при его восстановлении можно получить различные модификации кремния.
Аморфный кремний представляет собой бурый порошок, кристаллический - светло-серые твердые хрупкие кристаллы металлического вида. В кристаллической решетке каждый атом кремния находится в состоянии sp 3 -гибридизации и окружен четырьмя другими атомами, с которыми он связан ковалентной связью - кристаллический кремний подобен алмазу.
Кремний широко используется в микроэлектронике в качестве полупроводникового материала для микросхем и в металлургии для получения чистых металлов.
§ 4.2. Химические свойства углерода и кремния
1. В реакциях с простыми веществами, образованными более электроотрицательными элементами (кислород, галогены, азот, сера), углерод и кремний проявляют свойства восстановителей . При нагревании графита и кремния с избытком кислорода образуются высшие оксиды, а при недостатке кислорода - монооксиды CO и SiO:
Э + O 2 = ЭO 2 (избыток кислорода);
2Э + O 2 = 2ЭO (недостаток кислорода).
Со фтором углерод и кремний реагируют при обычных условиях с образованием тетрафторидов CF 4 и SiF 4 , для получения тетрахлоридов CCl 4 и SiCl 4 необходимо нагревание реагирующих веществ. Сера и азот вступают в реакции с углеродом и кремнием только при сильном нагревании:
C + 2S CS 2 ;
2C + N 2 C 2 N 2 ;
Si + 2S SiS 2 .
При нагревании смеси кварцевого песка и кокса при температуре около 2000 ° С образуется карбид кремния, или карборунд - тугоплавкое вещество, по твердости близкое к алмазу:
SiO 2 + 3C = SiC + 2CO.
Углерод часто используют для восстановления малоактивных металлов из их оксидов и для перевода сульфатов металлов в сульфиды:
CuO + C Cu + CO ,
BaSO 4 + 4C BaS + 4CO.
2. Реакции с кислотами . К действию обычных кислот углерод и кремний устойчивы. Углерод окисляется концентрированными серной и азотной кислотами:
C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O;
3C + 4HNO 3 = 3CO 2 + 4NO + 2H 2 O.
Кремний в концентрированных серной и азотной кислотах пассивируется и растворяется в смесях концентрированных азотной и плавиковой кислот и: концентрированных азотной и соляной кислот
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8H 2 O.
В этой реакции азотная кислота играет роль окислителя, а плавиковая или соляная - комплексообразователя.
3. Реакции со щелочами . Кремний растворяется в водных растворах щелочей с выделением водорода:
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2 H 2 .
4. Взаимодействие с водой . В обычных условиях кремний с водой не взаимодействует, но при высокой температуре он реагирует с водяным паром:
Si + = H 2 SiO 3 + 2H 2 .
5. Окислительные свойства углерода и кремния проявляются в реакциях с активными металлами, при этом образуются карбиды и силициды :
Ca + 2C = CaC 2 ;
2Mg + Si = Mg 2 Si.
6. Углерод и кремний способны диспропорционировать при нагревании с оксидами активных металлов, образуя оксиды, карбиды и силициды:
CaO + 3C = CaC 2 + CO ;
2Al 2 O 3 + 9C = Al 4 C 3 + 6CO ;
2MgO + 3Si = Mg 2 Si + 2SiO.
§ 4.3. Кислородные соединения углерода и кремния
ОКСИД УГЛЕРОДА(II) CO, или угарный газ, при обычных условиях - газ без цвета и запаха, t пл = –205 ° C, t кип = = –191,5 ° C. Он сильно ядовит, горит голубоватым пламенем, легче воздуха, плохо растворим в воде (2,3 объема CO на 100 объемов H 2 O при 293 К).
Угарный газ образуется при сжигании углерода в недостатке кислорода, кроме того, CO можно получать при взаимодействии раскаленного угля с водяным паром или с диоксидом углерода:
C + H 2 O CO + H 2 ;
CO 2 + C 2CO.
Получение. В лаборатории CO получают обезвоживанием муравьиной или щавелевой кислот в присутствии серной кислоты как водоотнимающего средства:
HCOOH CO + H 2 O;
H 2 C 2 O 4 CO + CO 2 + H 2 O.
Химические свойства. 1. При пропускании оксида углерода(II) в расплав щелочи при высоком давлении образуется соль муравьиной кислоты:
CO + KOH = HCOOK.
Эта реакция, а также лабораторный способ получения CO обезвоживанием муравьиной кислоты позволяют формально считать, что CO - ангидрид муравьиной кислоты. Однако это утверждение именно формально, поскольку обратный процесс получения муравьиной кислоты при гидратации монооксида углерода осуществить нельзя.
Степень окисления углерода в монооксиде углерода - +2 - не соответствует строению молекулы CO, в которой помимо двух связей, образованных при спаривании электронов углерода и кислорода, имеется еще одна, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Наличие тройной связи объясняет прочность молекулы CO и ее низкую реакционную способность при обычной температуре. В обычных условиях монооксид углерода не взаимодействует с водой, щелочами и кислотами.
2. При повышенной температуре CO взаимодействует с кислородом и оксидами металлов:
2CO + O 2 = 2CO 2 ;
FeO + CO = Fe + CO 2 .
3. При пропускании смеси угарного газа с хлором через слой активированного угля можно получить отравляющее вещество - ядовитый газ фосген , вызывающий паралич дыхательных путей:
CO + Cl 2 = COCl 2 .
4. При нагревании монооксида углерода с водородом при повышенном давлении образуется метиловый спирт:
CO + 2H 2 → С H 3 OH.
Карбонилы. Оксид углерода(II) взаимодействует со многими переходными металлами с образованием летучих соединений - карбонилов :
Ni + 4CO = Ni(CO) 4 .
В молекуле CO у атома углерода имеется неподеленная электронная пара, которая обусловливает донорные свойства этой молекулы. Ковалентная связь Ni – C в молекуле карбонила никеля образуется по донорно-акцепторному механизму, причем электронная плотность смещается от атома углерода к атому никеля. Увеличение отрицательного заряда на атоме металла компенсируется участием его d -электронов в образовании связи, поэтому степень окисления металла в карбониле равна нулю.
Карбонилы металлов растворимы в неполярных растворителях, летучи. Их используют для получения чистых металлов, поскольку при нагревании они разлагаются на металл и оксид углерода(II). Для определения состава карбонилов используют так называемое правило 18 электронов: суммарное число валентных электронов металла и электронов, предоставляемых молекулами CO (по 2 от каждой), должно быть равно 18. Металлы с нечетным атомным номером не могут образовать таким путем 18-электронную оболочку, поэтому для них характерны полимерные (в основном димерные) карбонилы, например 2 . В димерных карбонилах возникает связь металл - металл, и молекулы CO осуществляют мостиковую связь.
Оксид углерода СО является хорошим восстановителем солей серебра из из аммиачных растворов его солей:
2OH + CO = 2Ag↓ + (NH 4) 2 CO 3 + 2 NH 3
ОКСИД КРЕМНИЯ(II) SiO получают совместным испарением в вакууме смеси SiO 2 и Si при температуре 1100–1300 ° С. Для восстановления оксида SiO 2 в монооксид SiO можно также применять водород или углерод, процессы при этом необходимо вести при температуре 1000 ° С.
SiO 2 + H 2 = SiO + H 2 O;
SiO 2 + C = SiO + CO.
Оксид кремния(II) представляет собой коричневый порошок, который на воздухе быстро окисляется в диоксид. В щелочах и плавиковой кислоте SiO легко растворяется.
Это соединение используют в основном как пигмент для масляных красок и полирующее вещество.
ОКСИД УГЛЕРОДА(IV) (диоксид углерода, углекислый газ, угольный ангидрид) CO 2 - газ без цвета и запаха, не поддерживающий дыхания и горения, тяжелее воздуха, t пл = –57 ° C при давлении 5 атм, растворим в воде (88 объемов CO 2 в 100 объемах H 2 O при 20 ° С). При обычном давлении твердый диоксид углерода переходит в газообразное состояние, минуя жидкое (сублимируется ). При обычной температуре под давлением 60 атм газ превращается в жидкость. Молекула CO 2 линейная, с двумя двойными связями:
O=C=O
В промышленности для получения оксида углерода(IV) используют высокотемпературное разложение мрамора:
CaCO 3 CaO + CO 2 .
В лаборатории для получения больших количеств диоксида углерода на мрамор действуют соляной кислотой:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 .
Для обнаружения выделяющегося CO 2 его пропускают через известковую воду, при этом выпадает белый осадок карбоната кальция:
Ca(OH) 2 + CO 2 = CaCO 3 ¯ + H 2 O.
Необходимо помнить, что в атмосфере CO 2 зажженый магний не гаснет, а продолжает гореть:
2Mg + CO 2 = 2MgO + C
УГОЛЬНАЯ КИСЛОТА H 2 CO 3 в незначительных количествах образуется при растворении углекислого газа в воде, при этом в растворе существуют следующие равновесия:
H 2 O + CO 2 ↔ H 2 CO 3 ↔ H + + ↔ 2H + + .
При 25 ° С K 1 = 4 × 10 –7 , K 2 = 5 × 10 –11 . Угольная кислота - очень слабая и неустойчива в свободном виде. Она имеет следующее строение:
Как двухосновная кислота она образует средние соли ¾ карбонаты и кислые ¾ гидрокарбонаты . При действии на соли угольной кислоты сильных кислот выделяется углекислый газ, что используют как качественную реакцию на эти соли:
NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
BaCO 3 + 2HCl = BaCl 2 + CO 2 + H 2 O.
Из всех карбонатов в воде растворимы только карбонаты щелочных металлов (Li 2 CO 3 растворим хуже всех) и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода(IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
CaCO 3 + H 2 O + CO 2 = Ca(HCO 3) 2 .
При нагревании гидрокарбонаты распадаются на карбонаты, углекислый газ и воду:
2NaHCO 3 Na 2 CO 3 + H 2 O + CO 2 .
Все карбонаты, кроме термически устойчивых карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода:
CaCO 3 CaO + CO 2 .
Кроме средних и кислых карбонатов, известны основные карбонаты. Они образуются при действии на соли малоактивных металлов средними карбонатами:
2CuSO 4 + 3Na 2 CO 3 + 2H 2 O =
= Cu(OH) 2 ·CuCO 3 + 2NaHCO 3 + 2Na 2 SO 4 .
Основной карбонат меди Cu(OH) 2 ·CuCO 3 известен в природе под названием «малахит».
Из солей угольной кислоты наибольшее практическое значение имеют сода Na 2 CO 3 и ее различные кристаллогидраты: Na 2 CO 3 × 10H 2 O (кристаллическая сода), Na 2 CO 3 × 7H 2 O и Na 2 CO 3 × H 2 O, а также поташ K 2 CO 3 , мел, известняк и мрамор, имеющие состав CaCO 3 .
ОКСИД КРЕМНИЯ(IV) , или кремнезем , SiO 2 ¾ твердое, очень тугоплавкое вещество (температура плавления более 1700 ° С), встречается в природе в виде минералов кварца , кристобалита и тридимита .
При обычной температуре устойчивой модификацией является кварц, с ростом температуры наблюдаются полиморфные превращения:
кварц тридимит кристобалит расплав.
Строение. Во всех своих модификациях диоксид кремния всегда полимерен (SiO 2) n и построен из тетраэдров , образующих очень прочную атомную решетку. Каждый атом кремния в кристаллах (SiO 2) n окружен четырьмя атомами кислорода, которые являются мостиковыми и связывают под разными углами тетраэдры . В результате образуется трехмерная кристаллическая решетка, в которой взаимное расположение тетраэдров в пространстве определяет ту или иную модификацию кремнезема.
Кварц встречается в природе в виде хорошо сформированных бесцветных кристаллов, называемых горным хрусталем . Существуют и окрашенные разновидности кварца: розовый кварц, фиолетовый (аметист ), темно-коричневый (дымчатый топаз ), зеленый (хризопраз ). Мелкокристаллическая модификация кварца с примесями других веществ называется халцедоном . Разновидностями халцедона являются агат, яшма и др. Горный хрусталь и окрашенные разновидности кварца используют как драгоценные и полудрагоценные камни.
Кварц широко применяют в различных областях науки, техники и микроэлектроники, и часто для нужд последней выращивают искусственные кристаллы с определенными параметрами кристаллической решетки.
Некоторые кристаллы кварца способны вращать плоскость поляризации света, причем могут быть как право-, так и левовращающими. Те и другие кристаллы отличаются друг от друга как предмет от своего зеркального изображения. Такие кристаллы являются оптическими изомерами .
Тридимит в небольших количествах встречается в вулканических породах. Известен тридимит и метеоритного происхождения. Кристобалит , как и тридимит, иногда встречается в виде мелких кристаллов, включенных в лаву. Тридимит и кристобалит обладают более рыхлой структурой, нежели кварц. Так, плотность кристобалита, тридимита и кварца равна соответственно 2,32; 2,26 и 2,65 г/см 3 .
При медленном охлаждении расплава кремнезема образуется аморфное кварцевое стекло. Кремнезем в виде стекла встречается и в природе. Плотность аморфного стекла равна 2,20 г/см 3 - ниже, чем у всех кристаллических модификаций. При температуре выше 1000 ° С кварцевое стекло «расстекловывается» и переходит в кристобалит, поэтому в кварцевой лабораторной посуде можно проводить эксперименты только при температурах ниже 1000 ° С.
Химические свойства. 1. Все формы SiO 2 в воде практически нерастворимы, при обычных условиях на них действуют лишь растворы щелочей, фтор, газообразный фтороводород и плавиковая кислота :
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O;
SiO 2 + 4HF = SiF 4 + 2H 2 O;
SiO 2 + 6HF = H 2 + 2H 2 O.
Последнюю реакцию используют при травлении стекла.
2. Диоксид кремния - типичный кислотный оксид , поэтому при сплавлении он реагирует с основными оксидами, щелочами и карбонатами с образованием силикатов:
SiO 2 + CaO = CaSiO 3 ;
SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O ;
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2 .
Приведенные выше реакции диоксида кремния с оксидами и солями лежат в основе промышленного получения различных стекол , а также цемента .
Стекла. Обычное стекло, имеющее состав Na 2 O × CaO × 6SiO 2 , получают сплавлением смеси соды, песка и известняка при температуре около 1400 ° С до полного удаления газов:
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O × CaO × 6SiO 2 + 2CO 2 .
При добавлении оксидов бария, свинца и бора получают специальные сорта стекол, например огнеупорные, небьющиеся. Для получения цветных стекол используют различные оксиды переходных металлов, например добавка оксида кобальта(III) Co 2 O 3 дает синий цвет, оксида хрома(III) Cr 2 O 3 ¾ зеленый, диоксида марганца MnO 2 ¾ розовый.
Цементы. Силикаты широко используют для производства цемента - вяжущего материала, который при смешивании с водой затвердевает. Можно выделить два типа цементов по принципу их схватывания ¾ обычный цемент и портланд цемент . Процесс схватывания обычного цемента происходит вследствие образования карбоната кальция при взаимодействии углекислого газа воздуха и силиката кальция:
CaSiO 3 + CO 2 + H 2 O = CaCO 3 ¯ + H 2 SiO 3 ¯ .
Схватывание портланд цемента происходит в результате гидролиза силикатов с последующим образованием нерастворимых кристаллогидратов:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca(OH) 2 ;
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4 × 4H 2 O ¯ .
Кремниевые кислоты получают действием минеральных кислот на растворы силикатов или гидролизом галогенидов и сульфидов кремния, поскольку прямое взаимодействие кремнезема с водой невозможно.
Состав кремниевых кислот можно выразить общей формулой x SiO 2 × y H 2 O, где x и y ¾ целые числа. При x = 1, y = 1: получаем SiO 2 × H 2 O т. е. H 2 SiO 3 ¾ метакремниевую кислоту ; при x = 1, y = 2 - SiO 2 × 2H 2 O, т. е. H 4 SiO 4 ¾ орто кремниевую кислоту; при x = 2, y = 1 - 2SiO 2 × H 2 O, т. е. H 2 Si 2 O 5 ¾ двуметакремниевую кислоту .
Если y > 2, то кислоты относят к поликремниевым .
Силикаты - соли метакремниевой, или просто кремниевой кислоты H 2 SiO 3 . Из них в воде растворимы только силикаты натрия и калия, называемые жидким стеклом. Жидкое стекло используют для укрепления грунтов, для изготовления силикатного клея и огнеупорных тканей. Остальные силикаты ¾ тугоплавкие, нерастворимые в воде вещества. При нагревании кремниевая кислота разлагается:
H 2 SiO 3 SiO 2 + H 2 O.
При хранении на воздухе растворы силикатов мутнеют из-за вытеснения кремниевой кислоты углекислым газом, содержащимся в воздухе: кремниевая кислота слабее угольной; константа диссоциации H 2 SiO 3 по первой ступени равна 2,2 × 10 –10 .
Реакция силикатов с углекислым газом является качественной для обнаружения силикат-ионов:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ¯ .
Водные растворы растворимых силикатов имеют сильнощелочную реакцию среды вследствие гидролиза:
K 2 SiO 3 + H 2 O 2KOH + H 2 SiO 3 ¯ .
§ 4 .4. Карбиды и силициды
Соединения углерода и кремния с менее электроотрицательными элементами (чаще всего с металлами) называют карбидами и силицидами . Кроме реакций, уравнения которых приведены выше (см. § 13.2), для получения силицидов используют сплавление гидридов металлов с кремнием:
2CaH 2 + Si = Ca 2 Si + 2H 2 ;
восстановление металлов из их оксидов кремнием или углеродом в присутствии оксида кремния:
2CaO + 3Si = 2CaSi + SiO 2 ;
CaO + SiO 2 + 3C = CaSi + 3CO;
взаимодействие металлов с SiCl 4 в атмосфере водорода:
Ba + SiCl 4 + 2H 2 = BaSi + 4HCl.
Все эти реакции протекают при высокой температуре и иногда при повышенном давлении.
Среди ионных карбидов выделяют так называемые метаниды и ацетилениды. Метаниды можно рассматривать как производные метана, содержащие углерод в степени окисления –4: Be 2 C, Al 4 C 3 . Они интенсивно разлагаются водой с выделением метана:
Al 4 C 3 + 12H 2 O = 4Al(OH) 3 ¯ + 3CH 4 .
Ацетилениды - производные ацетилена, в них степень окисления углерода равна –1: Li 2 C 2 , Ag 2 C 2 , Cu 2 C 2 , CaC 2 , Al 2 (C 2) 3 , Fe 2 (C 2) 3 . Ацетилениды серебра и меди(I) получают при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди(I). Ацетилениды - сильно взрывчатые вещества и интенсивно разлагаются водой и кислотами с выделением ацетилена:
CaC 2 + 2H 2 O = Ca(OH) 2 + C 2 H 2 ;
CuC 2 + 2HCl = CuCl 2 + C 2 H 2 .
§ 4.5. Водородные соединения элементов четвертой группы
Рассмотрим лишь водородные соединения кремния (силаны), германия (германы), олова (станнаны) и свинца (плюмбаны), поскольку химия водородных соединений углерода будет изложена а органической химии.
Получение. При взаимодействии силицидов активных металлов (Mg, Ca, Li) с водой и кислотами выделяется простейшее водородное соединение кремния - моносилан SiH 4 , которое чаще всего называют просто силан :
Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4 .
Наиболее общим способом получения водородсодержащих соединений элементов четвертой группы является взаимодействие тетрахлоридов элементов с тетрагидроалюминатом лития:
GeCl 4 + Li [ AlH 4 ] = GeH 4 + LiCl + AlCl 3
Строение и свойства. Кремневодороды по своему строению подобны углеводородам. Молекула силана имеет форму правильного тетраэдра с атомом кремния в центре. Силан - бесцветный газ, имеющий запах плесени, самопроизвольно воспламеняющийся на воздухе, t пл = –185 ° C, t кип = –112 ° C. Силан сильно ядовит.
В отличие от метана силан взаимодействует с растворами щелочей:
SiH 4 + 2KOH + H 2 O = K 2 SiO 3 + 4H 2 .
Вода также гидролизует силан, но значительно медленнее:
SiH 4 + 2H 2 O = SiO 2 + 4H 2 .
При нагревании выше 400 ° С силан распадается на кремний и водород, это свойство используют для получения чистого кремния:
SiH 4 = Si + 2H 2 .
Как и углеводороды, силаны образуют гомологический ряд Si n H 2n +2 . В индивидуальном виде выделены силаны до n = 14 включительно. Подобно алканам, силаны бесцветны, первые члены гомологического ряда при обычных условиях газообразны, следующие ¾ жидкости. Химическая активность силанов гораздо выше, чем углеводородов. Это связано с меньшим по сравнению с углеродом сродством кремния к водороду и очень большим сродством кремния к кислороду, а также с меньшей прочностью связи Si – Si по сравнению со связью С – С. Малой прочностью связи Si – Si обусловлена и ограниченность гомологического ряда силанов.
Силан, Герман и станнан являются сильными восстановителями:
SiH 4 + 2AgCl = SiH 3 Cl + HCl + 2Ag
§ 4 .6. Соединения кремния с галогенами
Соединения кремния с галогенами можно рассматривать как производные силанов, в которых атомы водорода полностью или частично замещены на галоген. Тетрагалогениды кремния получают непосредственно из простых веществ. Реакция кремния со фтором происходит уже при обычной температуре, с хлором, бромом и иодом - при нагревании. При пропускании тока SiF 4 через воду образуется кремнефтористоводородная кислота H 2 SiF 6:
3SiF 4 + 2H 2 O = SiO 2 + 2H 2 SiF 6 .
Безводная кремнефтористоводородная кислота не выделена. Водный раствор ее представляет собой одну из самых сильных неорганических кислот. Разбавленные растворы используют как дезинфицирующее средство в пищевой промышленности. Растворимые соли кремнефтористоводородной кислоты применяют для пропитки стен зданий, построенных из кальцийсодержащих строительных материалов:
2CaCO 3 + MgSiF 6 = SiO 2 + 2CaF 2 + MgF 2 + 2CO 2 .
В результате реакции образуется мелкодисперсный порошок SiO 2 , который закрывает все поры, придает стенам водонепроницаемость и стойкость.
§ 4.7. Некоторые особенности элементов подгруппы германия
Германий содержится во многих минералах, но в очень небольших количествах, поэтому его называют рассеянным элементом . Важнейшие минералы германия: германит Cu 2 S × CuS × GeS 2 , аргиродит Ag 8 GeS 6 , реньерит Cu 3 (Fe, Ge)S 4 .
Основные минералы олова - касситерит SnO 2 (оловянный камень ), свинца - галенит PbS (свинцовый блеск ). Свинец как конечный продукт радиоактивного распада урана содержится в урановых минералах.
В ряду Ge - Sn - Pb увеличивается активность веществ по отношению к кислороду. В обычных условиях Ge и Sn устойчивы на воздухе, в то время как свинец окисляется до оксида PbO.
Олово и свинец реагируют с разбавленными соляной и серной кислотами с выделением водорода, а германий не реагирует с кислотами-неокислителями.
Германий окисляется концентрированными азотной, серной и плавиковой кислотами:
Ge + 4H 2 SO 4 Ge(SO 4) 2 + 2SO 2 + 4H 2 O;
Ge + 6HF = H 2 GeF 6 + 2H 2 ;
Ge + 4HNO 3 = GeO 2 + 4NO 2 + 2H 2 O.
Германий растворяется в «царской водке»:
3Ge + 4HNO 3 + 12HCl = 3GeCl 4 + 4NO + 8H 2 O
и в растворах щелочей в присутствии окислителей:
Ge + 2NaOH + 2H 2 O 2 = Na 2 .
При взаимодействии олова с концентрированной азотной кислотой образуется оловянная кислота H 2 SnO 3:
Sn + 4HNO 3 = H 2 SnO 3 + 4NO 2 + H 2 O.
В разбавленной HNO 3 олово ведет себя как металл, образуя нитрат олова(II):
3Sn + 8HNO 3 = 3Sn(NO 3) 2 + 2NO + 4H 2 O.
Свинец в реакциях с азотной кислотой любой концентрации выступает как металл и образует нитрат свинца(II) Pb(NO 3) 2 .
Среди соединений подгруппы германия в степени окисления (IV) для оксида свинца характерны окислительные свойства, он способен окислить воду до кислорода, ион Mn +2 до MnO 4 - :
2MnSO 4 + 5PbO 2 + H 2 SO 4 = 5PbSO 4 ↓ + 2HMnO 4 + 2H 2 O.
В ряду соединений Ge (II) – Sn (II) – Pb (II) ослабевают восстановительные свойства, самыми сильными восстановителями являются прозводные германия и олова:
Na + 2Bi(NO 3) 3 9NaOH = 2Bi↓+ 3 Na 2 ]Sn(OH) 6 ] + 6NaNO 3
Под углеродом подразумевается химический элемент, с неметаллическими свойствами. Он обозначается буквой С и считается химическим элементом четвертой группы второго периода в периодической системе Менделеева. Его порядковый номер 6, а атомная масса составляет 12,0107. Сегодня известно несколько видов модификаций углерода. Алмаз, графит являются углеродом, при этом различаются они строением своей кристаллической решетки. Существуют также фуллерен, карбин и менее известный лонсдейлит, который был найден в метеоритах, которые упали на землю. В очень больших количествах углерод также содержится в каменных углях, которые используются в качестве топлива. Также из него производятся угольные электроды для промышленных печей и т.п.
Промышленные способы изготовления углерода
Существует сегодня четыре наиболее распространенных способов получения технического углерода. В их основе лежит термоокислительное разложение газообразных и жидких углеводородов. Однако, в зависимости от используемого сырья, различают: печной, ламповый, термический и канальный способы. Кроме промышленных способов существует несколько способов, при которых также можно получить углерод.
Отличным способом получения углерода в домашних условиях считается изготовление соединения углерода с помощью сахара. Для данного эксперимента вам понадобится концентрат серной кислоты, перчатки, сахар, вода и серная кислота.
- Перед тем, как получить углерод, нужно взять стеклянную колбу.
- Далее насыпьте в нее немного сахара.
- После этого налейте в эту же колбу воду. Количество воды должно на два сантиметра превышать уровень сахара.
- Далее следует быть очень аккуратным, так как дело вам предстоит иметь с серной кислотой.
- Возьмите концентрированную серную кислоту, далее осторожно небольшими каплями добавьте ее в эту же колбу с сахаром. Через некоторое время в колбе будет образован чистый углерод.
Также существует еще один способ при использовании резины:
- Возьмите металлическую емкость, которая дополнительно имеет плотнозакрывающуюся крышку и газоотводную трубку.
- Далее погрузите в эту емкость кусок резины.
- После этого нужно поставить емкость на газовую горелку.
- Конец газоотводной трубки нужно будет опустить в банку. Во время нагревания без воздуха, резина не будет гореть, она будет разлагаться, при этом из газоотводной трубки выходить будут газы (метан, жидкие углеводороды).
- Через некоторое время у вас на дне емкости должен остаться углерод. Формула данного соединения будет содержать в себе большое количества С, то есть углерода.
Более простым способом считается получение оксида углерода. Заметим, что перед тем, как получить оксид углерода нужно иметь простой этилен. При его сгорании (C 2 H 4 +3O 2 =2CO 2 +2H 2 O) вы получите оксид углерода и воду.
Обратите внимание: При работе с кислотой вы должны принимать меры предосторожности (надевать перчатки и очки). Во время термического разложения резины данный эксперимент нужно проводить только на открытом воздухе или в проветриваемом помещении.
План работы:
Введение
Строение атома углерода.
Распространение в природе.
Получение углерода.
Физические и химические свойства.
Народнохозяйственное значение.
Углерод в организме.
Список литературы.
Введение
Углерод (лат. Carboneum), С - химический элемент IV группы периодической
системы Менделеева. Известны два стабильных изотопа 12С (98,892 %) и 13С
(1,108 %).
Углерод известен с глубокой древности. Древесный уголь служил для
восстановления металлов из руд, алмаз - как драгоценный камень.
Значительно позднее стали применяться графит для изготовления тиглей и
карандашей.
В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом,
как и при нагревании угля с селитрой, выделяется углекислый газ.
Химический состав алмаза был установлен в результате опытов А.Лавуазье
(1772) по изучения горения алмаза на воздухе и исследований С.Теннанта
(1797), доказавшего, что одинаковые количества алмаза и угля дают при
окислении равные количества углекислого газа. Углерод как химический
элемент был признан только в 1789 А.Лавуазье. Латинское название
сarboneum углерод получил от сarbo - уголь.
Строение атома углерода.
Ядро наиболее стабильного изотопа углерода массой 12 (распространенность
98,9%) имеет 6 протонов и 6 нейтронов (12 нуклонов), расположенных тремя
квартетами, каждый содержит 2 протона и два нейтрона аналогично ядру
гелия. Другой стабильный изотоп углерода – 13C (ок. 1,1%), а в следовых
количествах существует в природе нестабильный изотоп 14C с периодом
полураспада 5730 лет, обладающий?-излучением. В нормальном углеродном
цикле живой материи участвуют все три изотопа в виде СO2. После смерти
живого организма расход углерода прекращается и можно датировать
С-содержащие объекты, измеряя уровень радиоактивности 14С. Снижение
?-излучения 14CO2 пропорционально времени, прошедшему с момента смерти.
В 1960 У.Либби за исследования с радиоактивным углеродом был удостоен
Нобелевской премии.
В основном состоянии 6 электронов углерода образуют электронную
конфигурацию 1s22s22px12py12pz0. Четыре электрона второго уровня
являются валентными, что соответствует положению углерода в IVA группе
периодической системы. Поскольку для отрыва электрона от атома в газовой
фазе требуется большая энергия (ок. 1070 кДж/моль), углерод не образует
ионные связи с другими элементами, так как для этого необходим был бы
отрыв электрона с образованием положительного иона. Имея
электроотрицательность, равную 2,5, углерод не проявляет и сильного
сродства к электрону, соответственно не являясь активным акцептором
электронов. Поэтому он не склонен к образованию частицы с отрицательным
зарядом. Но с частично ионным характером связи некоторые соединения
углерода существуют, например, карбиды. В соединениях углерод проявляет
степень окисления 4. Чтобы четыре электрона смогли участвовать в
образовании связей, необходимо распаривание 2s-электронов и перескок
одного из этих электронов на 2pz-орбиталь; при этом образуются 4
тетраэдрические связи с углом между ними 109?. В соединениях валентные
электроны углерода лишь частично оттянуты от него, поэтому углерод
образует прочные ковалентные связи между соседними атомами типа С–С с
помощью общей электронной пары. Энергия разрыва такой связи равна 335
кДж/моль, тогда как для связи Si–Si она составляет всего 210 кДж/моль,
поэтому длинные цепочки –Si–Si– неустойчивы. Ковалентный характер связи
сохраняется даже в соединениях высокореакционноспособных галогенов с
углеродом, CF4 и CCl4. Углеродные атомы способны предоставлять на
образование связи более одного электрона от каждого атома углерода; так
образуются двойная С=С и тройная С?С связи. Другие элементы также
образуют связи между своими атомами, но только углерод способен
образовывать длинные цепи. Поэтому для углерода известны тысячи
соединений, называемых углеводородами, в которых углерод связан с
водородом и другими углеродными атомами, образуя длинные цепи или
кольцевые структуры.
В этих соединениях возможно замещение водорода на другие атомы, наиболее
часто на кислород, азот и галогены с образованием множества органических
соединений. Важное значение среди них занимают фторуглеводороды –
углеводороды, в которых водород замещен на фтор. Такие соединения
чрезвычайно инертны, и их используют как пластичные и смазочные
материалы (фторуглероды, т.е. углеводороды, в которых все атомы водорода
замещены на атомы фтора) и как низкотемпературные хладагенты (хладоны,
или фреоны, – фторхлоруглеводороды).
Распространение в природе:
В атоме углерода на его внешних четырех АО имеется четыре электрона.
Поэтому все четыре АО принимают участие в образовании химических связей.
Этим объясняется разнообразие и многочисленность соединений углерода.
Подавляющее большинство соединений углерода относят к так называемым
органическим веществам. В этом разделе рассмотрим свойства
неорганических веществ, образуемых углеродом, - простых веществ, его
оксидов, угольной кислоты и некоторых ее солей.
Углерод образует несколько простых веществ. Среди них пока важнейшими
считаются алмаз и графит. Эти аллотропные модификации имеют атомные
кристаллические решетки, которые различаются своими структурами. Отсюда
отличие их физических и химических свойств.
В алмазе каждый атом углерода связан с четырьмя другими атомами. В
пространстве эти атомы располагаются в центре и углах тетраэдров,
соединенных своими вершинами. Это очень симметричная и прочная решетка.
Алмаз – это самое твердое вещество на Земле.
В графите каждый атом соединен с тремя другими, лежащими в той же
плоскости. На образование этих связей затрачивается по три АО с тремя
электронами. Четвертая орбиталь 2р-АО с одним электроном располагается
перпендикулярно плоскости. Эти оставшиеся атомные орбиталь всей сетки
перекрываются между собой, образуя зону молекулярных орбиталей. Эта зона
занята не полностью, а наполовину, что обеспечивает металлическую
электропроводность графита (в отличие от алмаза).
Помимо электропроводности графит обладает еще тремя практически важными
свойствами.
Во-первых, тугоплавкость. Температура плавления графита выше 3500? С –
это самое тугоплавкое простое вещество на Земле.
Во-вторых, отсутствие на его поверхности каких-либо продуктов
взаимодействия с окружающей средой (на металлах это оксиды),
увеличивающих электрическое сопротивление.
В-третьих, способность оказывать смазывающее действие на трущиеся
поверхности. В кристалле графита атомы углерода прочно связаны между
собой в плоских сетках, а связь между сетками слабая, она имеет
межмолекулярную природу, как в веществах с молекулярными решетками.
Поэтому уже небольшие механические усилия вызывают смещение сеток
относително друг друга, что и обусловливает действие графита как смазки.
Энергия связи между атомами углерода в простых и сложных веществах, в
том числе и в алмазе, и в графите. Очень велика. О твердости алмаза уже
говорили. Прочна связь между атомами и в графитовой сетке. Так,
прочность на разрыв волокна из графита значительно превышает прочность
железа и технической стали.
На основе графита изготавливают так называемые композиционные материалы,
в частности углепластики, в которых волокна графита находятся на матрице
из эпоксидной смолы. Композиционные материалы все шире применяются в
авиационной и космической технике (ведь помимо прочности они легкие;
сравним плотность графита, р=2,3 г/см3 ,с плотностью «легкого» алюминия,
р=2,7г/см3, и тем более железа, р=7,9г/см3), а также в судостроении, где
особенно ценна коррозионная стойкость.
Углерод Соединения углерода
Оксид углерода (1У) Угольная кислота
Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен и др.
Проявляет восстановительные свойства
Горит в кислороде: С+О2=СО2+Q
Взаимодействует с оксидом углерода (1У): С+СО2=2СО
Восстанавливает металлы из их оксидов: 3С+Fe2O3=3CO2+4Fe
Получение
Неполное сжигание метана: СН4+О2=С+2Н2О газ без запаха, цвета и вкуса,
тяжелее воздуха
Кислотный оксид
При растворении взаимодействует с водой: СО2+Н2О=Н2СО3
Реагирует с основаниями:
CO2+Ca(OH)2=CaCO3+H2O
5.Реагирует с основными оксидами:
6.Образуется в реакциях
А) горения углерода в кислороде:
Б) окисления оксида углерода (II):
В) сгорания метана:
CH4+O2=CO2+2H2O
Г) взаимодействие кислот с карбонатами:
CaCO3+2HCI=CaCI2+CO2+H2O
Д) термического разложения карбонатов, гидрокарбонатов:
2NaHCO3=Na2CO3+CO2+H2O
Е) окисления биохимических процессов дыхания, гниения.
1.Непрочная молекула. Слабая двухосновная кислота. В водном растворе
существуют равновесия.
2. Взаимодействует с растворами щелочей как раствор углекислого газа в
воде с образованием солей- кислых (гидрокарбонатов) и средних
(карбонатов):
CO2+NaOH=NaHCO3
CO2+2NaOH=Na2CO3+
3.Вытесняется из солей более сильными кислотами
CaCO3+2HCI=CaCI2+CO2+H2O
4.Соли угольной кислоты подвергаются гидролизу
Углерод химически инертен только при сравнительно низких температурах, а
при высоких – это один из сильнейших восстановителей. Главное химическое
применение углерода – восстановление металлов, в первую очередь железа,
из руд.
Оксиды углерода.
Имея четыре электрона во внешнем энергетическом уровне, углерод в
соединениях с кислородом в зависимости от условий проявляет валентности
+2 и +4.
При горении углеродосодержащих веществ (дрова, уголь, природный газ
метан, спирт и др.) при температуре обычного пламени идет реакция:
С + О2 = СО2
Но если создать условия для повышения температуры (например, уменьшить
теплоотвод, что может происходить внутри толстого слоя горящего угля, в
том числе в доменной печи), то протекают реакции:
С +О2 = 2СО
СО2 + С = 2СО
Продуктом полного сгорания углерода и содержащих его веществ является
оксид углерода (1У) СО2 – углекислый газ. Он же образуется при дыхании
живых организмов и гниении их остатков. Одновременно углекислый газ
(вместе с водой) является главным веществом, потребляемым растениями в
процессе их роста.
При повышении давления уже при комнатной температуре диоксид углерода
сжижается. Жидким СО2 заполняют некоторые типы огнетушителей.
При понижении давления жидкий оксид углерода закипает. При этом его
температура резко снижается, поскольку на порообразование, как известно
из физики, затрачивается большое количество теплоты. В результате СО2
затвердевает. В твердом виде (под названием «сухой лед») он применяется
в качестве хладоагента. При атмосферном давлении «сухой лед» не
плавится, а подобно иоду, фосфору, углероду возгоняется, только при
значительно более низкой температуре (-75? С).
Среднее содержание углерода в земной коре 2,3*10-2 % по массе (1*10 –2 в
ультраосновных, 1*10 –2 в основных, 2*10 –2 в средних, 3*10 –2 в кислых
горных породах). Углерода накапливается в верхней части земной коры
(биосфере): в живом веществе 18 % углерода, в древесине 50 %, в каменном
угле 80 %, в нефти 85 %, антраците 96 %. Значит часть углерода
литосферы сосредоточена в известняках и доломитах.
Число собственных минералов углерода - 112; исключительно велико число
органических соединений углерода - углеводородов и их производных.
С накоплением углерода в земной коре связано накопление и многих других
элементов, сорбируемых органическим веществом и осаждающихся в виде
нерастворимых карбонатов и т.д.
По сравнению со средним содержанием в земной коре человечество в
исключительно больших количествах извлекает углерод из недр (уголь,
нефть, природный газ), т.к. эти ископаемые - основные источники энергии.
Углерод широко распространён также в космосе; на Солнце он занимает 4-е
место после водорода, гелия и кислорода.
Получение углерода
Сухая перегонка
Древесины
каменного угля
Древесный уголь
кокс
Активированный уголь
Самый чистый углерод – сажа
Химические свойства
Малоактивен, на холоде – только с F2 (CF4
Восстановитель (Слабо выражены (Окислительные
1) O2 + C (CO2 ниже 500(C (
(загорается
CO2 + C (CO выше 900(C(
2) H2O + C (CO + H2 выше 1200(C
2H2O + C (CO2 + CO2 + H2 выше 1000(С
3) CuO + C (Cu + CO при (t
Cu+2 +2e(Cu0 – окислитель, восстанавливается
C0 -2e(C+2 – восстановитель, окисляется
4) HNO3 + 3C (3 CO2 + 4 NO + 2 H2O
С H2SO4 разбавленная
Cu+2 +2e(Cu0 – окислитель, восстанавливается
C0 -2e(C+2 – восстановитель, окисляется
1) Ca + 2C (Ca (((карбид кальция
C + Si (CSi карборунд
Другой способ:
CaO + C (CaC2 + CO
2) 2H2 + C (C-4H+4
Рассмотрим с точки зрения ox-red:
4H0 -4e(4H+ – восстановитель, окисляется
C0 +4e(C-4 – окислитель, восстанавливается
Углерод может быть и окислителем и восстановителем.
Оксид углерода (IV)
Без цвета и запаха, растворим в воде; -76(C – сухой лед; Получение: в
промышленности обжиг известняка
CaCO3 (CaO + CO2(
В лаборатории – вытеснение сильной кислотой CaCO3 + 2HCl (CaCl2+
Окислительные свойства выражены слабо: только при высоких температурах,
с металлами, сродство к кислороду, которых больше, чем у C (Mg, K)
2Mg + CO2 (2MgO + C
Кислотный оксид при растворении в воде, образуется небольшое количество
угольной кислоты
1. 2NaOH + CO2 (
Na2CO3 + H2O + CO2 (
Этим способом могут быть получены соли угольной кислоты. Другой способ:
2. Обменная реакция
BaCl2 + Na2CO3 (
(BaCO3(+ 2NaCl
Соли: 1) карбонаты, растворимы в воде – только щелочных и NH+4 сильный
гидролиз.
При нагревании Ca(HCO3)2 (CaCO3 +
CaCO3 (CO2 + CaO
Карбонаты щелочных металлов плавятся без разложения.
Качественная реакция
“вскипание” – сильная кислота
CaCO3 + 2HCl (CaCl2+
CO2 вызывает помутнение известковой и баритовой воды Ca(OH)2 +
CO2 (CaCO3 + H2O
Растворение, ведущее к разрушению старых известковых гор.
CaCO3 + H2O + CO2 ((Ca(HCO3)2 Оксид углерода (II)
CO (угарный газ)
Бесцветный газ, без запаха, ядовит, т.к. соединяется с гемоглобином
крови. Плохо растворим в воде. Получение: горение при недостатке O2
2CH4 + 3O2 (2CO(+
В лаборатории: действие концентрирован. H2SO4
HCOOH (CO(+ H2O
Щавелевая кислота H2C2O4 (CO(+ CO2(+
Восстановитель Fe2O3 +
3CO (2Fe + 3CO2(
O2 + 2CO (2CO2(
Несолеобразующий, но при t = 200(C, 20 атм
O – Na Органические соединения CH4 карбиды – получаются
при непосредственном взаимодействии с металлами.
2 группы.
I. Карбиды металлического характера. Переходные Me + C. Электронная
проводимость, металлический блеск.
II. Ионные карбиды более электроположительные, бесцветные, прозрачные,
не проводят электрический ток.
1) Al4C3 + 12H2O (
(4Al(OH)3 + 3CH4(
C Be2C – та же реакция
2) CaC2 + 2H2O (
(Ca(OH)2 + C2H2(
Na2C2; K2C2; SrC2; BaC2; Cu2C2
При гидролизе – ацетилен и ненасыщенные углеводороды из Mg2C2; Fe3C,
лантанидов.
Физические и химические свойства:
Известны четыре кристаллические модификации углерода: графит, алмаз,
карбин и лонсдейлит. Графит - серо-черная, непрозрачная, жирная на
ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При
комнатной температуре и нормальном давлении (0,1 Мн/м2, или 1кгс/см2)
графит термодинамически стабилен. Алмаз - очень твердое, кристаллическое
вещество. Кристаллы имеют кубическую гранецентрированную решетку:
а=3,560(. При комнатной температуре и нормальном давлении алмаз
метастабилен. Заметное превращение алмаза в графит наблюдается при
температурах выше 1400(С в вакууме или в инертной атмосфере. При
атмосферном давлении и температуре около 3700(С графит возгоняется.
Жидкий углерод может быть получен при давлении выше 10,5 Мн/м2 (1051
кгс/см2) и температурах выше 3700(С. Для твердого углерода (кокс, сажа,
древесный уголь) характерно также состояние с неупорядоченной структурой
“аморфный” углерод, который не представляет собой самостоятельной
модификации; в основе его строения лежит структура мелкокристаллического
графита. Нагревание некоторых разновидностей “аморфного” углерода выше
1500-1600(С без доступа воздуха вызывает их превращение в графит.
Физические свойства “аморфный” углерода очень сильно зависят от
дисперсности частиц и наличия примесей. Плотность, теплоемкость,
теплопроводность и электропроводность “аморфный” углерода всегда выше,
чем графита. Карбин получен искусственно. Он представляет собой
мелкокристаллический порошок черного цвета (плотность 1,9 - 2 г/см3).
Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
Лонсдейлит найден в метеоритах и получен искусственно; его структура и
свойства окончательно не установлены.
Конфигурация внешней оболочки атома углерода 2s22p2. Для углерода
характерно образование четырех ковалентных связей, обусловленное
возбуждение внешней электронной оболочки до состояния 2sp3. Поэтому
углерод способен в равной степени как притягивать, так и отдавать
электроны. Химическая связь может осуществляться за счет sp3-, sp2- и
sp- гибридных орбиталей, которым соответствуют координационные числа 4,3
и 2. Число валентных электронов углерода и число валентных орбиталей
одинаково; это одна из причин устойчивости связи между атомами углерода.
Уникальная способность атомов углерода соединяться между собой с
образованием прочных и длинных цепей и циклов привела к возникновению
громадного числа разнообразных соединений углерода, изучаемых
органической химией.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный
радиус 0,77(,ковалентные радиусы 0,77(, 0,67(, 0,60(соответственно в
одинарной, двойной и тройной связях; ионной радиус С4- 2,60(, С4+ 0,20(.
При обычных условиях углерод химически инертен, при высоких температурах
он соединяется со многими элементами, проявляя сильные восстановительные
свойства.
Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются
только очень сильными окислителями (хромовая смесь, смесь концентриров.
HNO3 и KCIO3 и др.). “Аморфный” углерод реагирует с фтором при комнатной
температуре, графит и алмаз - при нагревании. Непосредственно соединение
углерода с хлором происходит в электрической дуге; с бромом и йодом
углерод не реагирует, поэтому многочисленные углерода галогениды
синтезируют косвенным путем. Из оксигалогенидов общей формулы COX2 (где
Х - галоген) наиболее известная хлорокись COCI2 (фосген).
При температурах выше 1000(С углерод взаимодействует со многими
металлами, давая карбиды. Все формы углерода при нагревании
восстанавливают окислы металлов с образованием свободных металлов (Zn,
Cd, Cu, Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод
реагирует при температурах выше 600 - 800(С с водяным паром и углекислым
газом.
Все формы углерода нерастворимы в обычных неорганических и органических
растворителях, но растворяются в некоторых расплавленных металлах
(например, Fe, Ni, Co).
Народнохозяйственное значение:
Углерод определяется тем, что свыше 90 % всех первичных источников
потребляемой в мире энергии приходится на органическое топливо,
главенствующая роль которого сохранится и на ближайшие десятилетия,
несмотря на интенсивное развитие ядерной энергетики. Только около 10%
добываемого топлива используется в качестве сырья для основного
органического синтеза и нефтехимического синтеза, для получения
пластичных масс и др.
Углерод в организме:
Углерод - важнейший биогенный элемент, составляющий основу жизни на
Земле, структурная единица огромного числа органических соединений,
участвующих в построении организмов и обеспечении их жизнедеятельности
(биополимеры, а также многочисленные низкомолекулярные биологически
активные вещества - витамины, гормоны, медиаторы и др.). Значительную
часть необходимой организмам энергии образуется в клетках за счет
окисления углерода. Возникновение жизни на Земле рассматривается в
современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами,
которыми в совокупности не обладает ни один другой элемент периодической
системы. Между атомами углерода, а также между углеродом и другими
элементами образуются прочные химические связи, которые, однако, могут
быть разорваны в сравнительно мягких физиологических условиях (эти связи
могут быть одинарными, двойными и тройными). Способность углерода
образовывать 4 равнозначные валентные связи с другими атомами. Углерод
создает возможность для построения углеродных скелетов различных типов -
линейных, разветвленных, циклических. Показательно, что всего три
элемента - С, О, Н - составляют 98 % общей массы живых организмов. Этим
достигается определенная экономичность в живой природе: при практически
безграничном структурном разнообразии углеродистых соединений небольшое
число типов химических связей позволяет на много сократить количество
ферментов, необходимых для расщепления и синтеза органических веществ.
Особенности строения атома углерода лежит в основе различных видов
изомерии органических соединений (способность к оптической изомерии
оказалась решающей в биохимической эволюции аминокислот, углеводов и
некоторых алкалоидов).
Согласно гипотезе А. И. Опарина, первые органические соединения на Земле
имели абиогенное происхождение. Источниками углерода служили (СН4)и
цианистый водород (HCN),содержавшиеся в первичной атмосфере Земли. С
возникновением жизни единственным источником неорганического углерода,
за счет которого образуется всё органическое вещество биосферы, является
углерода двуокись (СО2),находящийся в атмосфере, а также растворенная в
природных водах в виде НСО3. Наиболее мощный механизм усвоения
(ассимиляция) углерода (в форме СО2) - фотосинтез - осуществляется
повсеместно зелеными растениями. На Земле существует и эволюционно более
древний способ усвоения СО2 путем хемосинтеза; в этом случае
микроорганизмы - хемосинтетики используют не лучистую энергию Солнца, а
энергию окисления неорганических соединений. Большинство животных
потребляют углерод с пищей в виде уже готовых органических соединений. В
зависимости от способа усвоения органических соединений принято
различать автотрофные организмы и гетеротрофные организмы. Применение
для биосинтеза белка и других питательных веществ микроорганизмов,
использующих в качестве единственного источника углерода, углеводороды
нефти, - одна из важных современных научно - технических проблем.
Помимо стабильных изотопов углерода, в природе распространен
радиоактивный 14С (в организме человека его содержится около 0,1мккюри).
С использованием изотопов углерода в биологических и медицинских
исследованиях связаны многие крупные достижения в изучении обмена
веществ и круговорота углерода в природе. Так, с помощью радиоуглеродной
метки была доказана возможность фиксации Н14СО3 растениями и тканями
животных, установлена последовательность реакции фотосинтеза, изучен
обмен аминокислот, прослежены пути биосинтеза многих биологически
активных соединений и т. д. Применение 14С способствовало успехам
молекулярной биологии в изучении механизмов биосинтеза белка и передачи
наследственной информации. Определение удельной активности 14С в
углеродсодержащих органических остатках позволяет судить об их возрасте,
что используется в палеонтологии и археологии.
Список литературы.
1. Ахметов Н.С. Неорганическая химия. Учеб. пособие для учащихся 8–9 кл.
шк. с углуб. изучением химии. В 2-х частях – ч. 1, ч. 2, – 2-е изд. –
М.: Просвещение, 1990 – 208 с.
2. Ахметов Н.С. Общая и неорганическая химия. Учеб. пособие для ВУЗов,
М.: Высшая школа, 1988 – 470 с.
3. Бабич Л.В., Балезин С.А., Гликина Ф.Б., Зак Э.Г. Практикум по
неорганической химии. Учеб. пособие для ВУЗов, М.: Высшая школа, 1989 –
300 с.
4. Башлак А.Т. “Что может зажечь углекислый газ”, ж. “Химия в школе”,
1991, № 5, с. 58.
Технический углерод (ГОСТ 7885-86) - вид промышленных углеродных продуктов, используемый в основном при производстве резины как наполнитель, усиливающий ее полезные эксплуатационные свойства. В отличие от кокса и пека, состоит почти из одного углерода, по виду напоминает сажу.
Область применения
Примерно 70 % выпускаемого техуглерода используют для изготовления шин, 20 % - для производства резино-технических изделий. Также углерод технический находит применение в лакокрасочном производстве и получении печатных красок, где он выполняет роль черного пигмента.
Еще одна область применения - производство пластмасс и оболочек кабелей. Здесь продукт добавляют в качестве наполнителя и придания изделиям специальных свойств. В небольших объемах применяется техуглерод и в других отраслях промышленности.

Характеристика
Технический углерод - продукт процесса, включающего новейшие инженерные технологии и Благодаря своей чистоте и строго определенному набору физических и химических свойств, он не имеет ничего общего с сажей, образующейся как загрязненный побочный продукт в результате сжигания угля и мазута, или при работе неотрегулированных двигателей внутреннего сгорания. По общепринятой международной классификации техуглерод обозначается Carbon Black (черный углерод в переводе с английского языка), сажа по-английски - soot. То есть эти понятия в настоящее время, никоим образом не смешиваются.
Эффект усиления за счет наполнения каучуков техуглеродом имел для развития резиновой промышленности не меньшее значение, чем открытие явления серой. В резиновых смесях углерод из большого количества при-меняемых ингредиентов по массе занимает второе место после каучука. Влияние же качественных показателей техуглерода на свойства резиновых изделий значительно больше, нежели качественных показателей основного ингредиента - каучука.
Усиливающие свойства
Улучшение физических свойств материала за счет введения наполнителя называется усилением (армированием), а такие наполнители называются усили-телями (техуглерод, осажденная окись кремния). Среди всех усилителей поистине уникальными характеристиками обладает углерод технический. Даже до вулканизации он связывается с каучуком, и эту смесь невоз-можно полностью разделить на carbon black и каучук при помощи растворителей.
Прочность резин, полученных на основе важнейших эластомеров:
Эластомер | Прочность при растяжении, МПа |
|
Ненаполненный вулканизат | Вулканизат с наполнением техуглеродом |
|
Бутадиенстирольный каучук | ||
Бутадиеннитрильный каучук | ||
Этиленпропиленовый каучук | ||
Полиакрилатный каучук | ||
Полибутадиеновый каучук | ||
В таблице показаны свойства вулканизатов, полученных из различных видов каучука без наполнения и наполненных техуглеродом. Из приведенных данных видно, как существенно влияет наполнение -углеродом на показатель прочности резин при растяжении. Кстати, другие дисперсные порошки, применяемые в резиновых смесях для придания нужной окраски или удешев-ления смеси — мел, каолин, тальк, окись железа и другие не обладают усиливаю-щими свойствами.
Структура
Чистые природные углероды - это алмазы и графит. Они имеют кристаллическую структуру, значительно отличаю-щуюся одна от другой. Методом дифракции рентгеновских лучей установлено сходство в струк-туре натурального графита и искусственного материала carbon black. Атомы углерода в графи-те образуют большие слои сконденсированных ароматических кольцеобразных систем, с межатомным расстоянием 0,142 нм. Эти графитовые слои сконденсированных ароматических систем при-нято называть базисными плоскостями. Расстояние между плоскостями строго определенное и составляет 0,335 нм. Все слои расположе-ны параллельно относительно друг другу. Плотность графита составляет 2,26 г/см 3 .
В отличие от графита, обладающего трехмерной упорядоченностью, углерод технический характеризуется только двухмерной упорядоченностью. Состоит он из хорошо развитых графитовых плоскостей, расположенных приблизительно параллельно друг другу, но смещенным по отношению к смежным слоям - то есть, плоскости произвольно ориентированы в отношении норма-ли.
Образно структуру графита сравнивают с аккуратно сложенной коло-дой карт, а структуру техуглерода с колодой карт в которой карты сдвинуты. В нем межплоскостное расстояние больше, чем у графита и составляет 0,350-0,365 нм. Поэтому плотность техуглерода ниже и находится в пределах 1,76-1,9 г/см 3 , в зависимости от марки (чаще всего 1,8 г/см 3).
Окрашивание
Пигментные (окрашивающие) марки технического углерода используются в производстве типографских красок, покрытий, пластмасс, волокон, бумаги и строительных материалов. Их классифицируют на:
- высокоокрашивающий техуглерод (НС);
- среднеокрашивающий (МС);
- нормальноокрашивающий (RC);
- низкоокрашивающий (LC).
Третья буква обозначает способ получения - печной (F) или канальный (С). Пример обозначения: HCF - высокоокрашивающий печной техуглерод (Hiqh Colour Furnace).

Окрашивающая способность продукта связана с размером его частиц. В зависимости от их размера углерод технический подразделяется по группам:
Классификация
Технический углерод для резин по степени усиливающего эффекта подразделяют на:
- Высокоусиливающий (протекторный, твердый). Выделяется повышенной прочностью и сопротивляемостью истиранию. Размер частиц мелкий (18-30 нм). Применяют в транспортерных лентах, протекторах шин.
- Полуусиливающий (каркасный, мягкий). Размер частиц средний (40-60 нм). Применяют в разноплановых резинотехнических изделиях, каркасах шин.
- Низкоусиливающий. Размер частиц крупный (свыше 60 нм). В шинной промышленности используется ограниченно. Обеспечивает необходимую прочность при сохранении высокой эластичности в резинотехнических изделиях.
Полная классификация техуглерода дана в стандарте ASTM D1765-03, принятом всеми мировыми производителями продукта и его потребителями. В нем классификация, в частности, ведется по диапазону удельной площади поверхности частиц:
№ группы | Средняя удельная площадь поверхности по адсорбции азота, м 2 /г |
Производство технического углерода
Различают три технологии получения промышленного техуглерода, в которых используется цикл неполного сжигания углеводородов:
- печной;
- канальный;
- ламповый;
- плазменный.
Также существует термический метод, при котором при высоких температурах происходит разложение ацетилена или природного газа.

Многочисленные марки, получаемые за счет различных технологий, обладают разнообразными характеристиками.
Технология изготовления
Теоретически возможно получение технического углерода всеми перечисленными способами, однако более 96 % производимого продукта получают печным спо-собом из жидкого сырья. Метод позволяет получать разнообразные марки техуглерода с определенным набором свойств. Например, на технического углерода по данной технологии производится более 20 марок техуглерода.
Общая технология такова. В реактор, футерованный высокоогнеупорными материалами, подается и нагретый до 800 °С воздух. За счет сжигания природного газа образуются продукты полного сгорания с температурой 1820-1900 °С, содержа-щие определенное количество свободного кислорода. В высокотемпературные продукты полного сгорания впрыскивается жидкое углеводородное сырье, предварительно тщательно перемешанное и нагретое до 200-300 °С. Пиролиз сырья происходит при строго контролируемой температуре, которая в зависи-мости от марки выпускаемого техуглерода имеет различные значения от 1400 до 1750 °С.
На определенном расстоянии от места подачи сырья термоокисли-тельная реакция прекращается посредством впрыска воды. Образовавшиеся в результате пиролиза технический углерод и газы реакции поступают в воздухоподогрева-тель, в котором они отдают часть своего тепла воздуху, используемому в про-цессе, при этом температура углеродогазовой смеси понижается от 950-1000 °С до 500-600 °С.
После охлаждения до 260-280 °С за счет дополнительного впрыска воды смесь технического углерода и газов направляется в рукавный фильтр, где тех-нический углерод отделяется от газов и поступает в бункер фильтра. Выделенный технический углерод из бункера фильтра по трубопро-воду газотранспорта подается вентилятором (турбовоздуходувкой) в от-деление гранулирования.

Производители технического углерода
Мировое производство техуглерода превышает 10 млн тонн. Такая большая потребность в продукте объясняется, прежде всего, его уникальными усиливающими свойствами. Локомотивами отрасли являются:
- Aditya Birla Group (Индия) - около 15 % рынка.
- Cabot Corporation (США) - 14 % рынка.
- Orion Engineered Carbons (Люксембург) - 9 %.
Крупнейшие российские производители углерода:
- ООО «Омсктехуглерод» - 40 % российского рынка. Заводы в Омске, Волгограде, Могилеве.
- ОАО «Ярославский технический углерод» - 32 %.
- ОАО «Нижнекамсктехуглерод» - 17 %.
