I. الخواص الفيزيائية والكيميائية والسامة لحمض الهيدروسيانيك والسيانيد وأول أكسيد الكربون. أعمال محفز الأكسدة ذو درجة الحرارة المنخفضة
صفحة - 14 -
مقدمة
تصنف المواد السامة (TS) ذات الفعل السام العام عادة على أنها مجموعة كبيرة من المركبات الكيميائية المتحدة تحت الاسم العام - السيانيد. سلف هذه المجموعة هو حمض الهيدروسيانيك، الذي تم الحصول عليه لأول مرة في شكل نقي في الثمانينات من القرن الثامن عشر من قبل الكيميائي والصيدلي السويدي كارل شيم من اللون الأزرق البروسي. يعرف التاريخ حالات استخدام السيانيد للتدمير الشامل للبشر. على سبيل المثال، خلال الحرب العالمية الأولى، استخدم الجيش الفرنسي تركيبات تحتوي على حمض الهيدروسيانيك كعوامل حرب كيميائية. في معسكرات الموت التابعة لهتلر، استخدم النازيون غازات الأعاصير السامة، وهي عبارة عن استرات حمض السيانوفورميك. استخدمت القوات الأمريكية في فيتنام الجنوبية السيانيد العضوي السام (غازات من النوع C) ضد المدنيين.
لا يمكن استبعاد احتمال التسمم بالسيانيد في وقت السلم، حيث يتم استخدام حمض الهيدروسيانيك وعدد كبير من مشتقاته في مجالات مختلفة من الاقتصاد الوطني لجميع البلدان تقريبا التي لديها صناعة كيميائية. نحن نتحدث عن استخدام السيانيد في إنتاج البلاستيك والمبيدات الحشرية والمطاط والمواد العطرية ومنشطات النمو. تعتبر مركبات السيانيد ضرورية لاستخراج المعادن الثمينة أثناء الطلاء الكهربائي والتذهيب والفضة. وبعبارة أخرى، فإن مجال التطبيق الصناعي للسيانيد واسع للغاية. في الحياة اليومية يحدث التسمم بالمواد التي تحتوي على مجموعة السيانوجين بسبب استهلاك كميات كبيرة من بذور اللوز والخوخ والمشمش والكرز والخوخ وغيرها من نباتات عائلة الوردية أو صبغات من ثمارها. وتبين أنها جميعها تحتوي على جليكوسيد الأميغدالين الذي يتحلل في الجسم تحت تأثير إنزيم المستحلب لتكوين حمض الهيدروسيانيك. في عالم الحيوان، يوجد حمض الهيدروسيانيك في الإفراز السام للغدد الجلدية لدى الديدان الألفية.
أما بالنسبة لل أول أكسيد الكربونوالذي له أيضًا تأثير سام عام على الجسم، وفي الوقت الحالي لا يوجد سبب لتصنيفه كعامل حربي كيميائي، وذلك بسبب استحالة خلق تركيزات قتالية لهذا الغاز على الأرض. يحدث التسمم بأول أكسيد الكربون غالبًا في المباني، والمرائب، والكابونيرز، والأنفاق، وما إلى ذلك. تشكل الانفجارات والحرائق داخل المباني ومحركات المكربن \u200b\u200bالخاملة خطراً كبيراً في ظروف عدم كفاية حركة الهواء. لذلك، يتم تناول التسمم بأول أكسيد الكربون وقضايا الوقاية من التسمم وعلاجه إلى حد كبير في أقسام علم السموم الصناعية والبلدية. وبالإضافة إلى ذلك، يتم عرض هذه القضايا بشكل كامل في الأدبيات المتاحة.
I. الخواص الفيزيائية والكيميائية والسامة لحمض الهيدروسيانيك والسيانيد وأول أكسيد الكربون.
حمض الهيدروسيانيك- سائل شفاف عديم اللون برائحة اللوز المر (بتركيزات منخفضة). يتم الشعور بالرائحة المميزة عند تركيز في الهواء قدره 0.0009 ملغم / لتر. نقطة الغليان +25 درجة مئوية، كثافة البخار النسبية في الهواء 0.93. يتم امتصاص أبخرة حمض الهيدروسيانيك بشكل سيئ بواسطة الكربون المنشط.
حمض الهيدروسيانيك هو حمض ضعيف، لأنه يمكن إزاحته من أملاحه بواسطة الأحماض الأضعف (على سبيل المثال، حمض الكربونيك). ولذلك، يتم تخزين أملاح حمض الهيدروسيانيك في حاويات محكمة الغلق.
عند التفاعل مع القلويات، يشكل حمض الهيدروسيانيك أملاحًا ليست أقل سمية من حمض الهيدروسيانيك نفسه (سيانيد البوتاسيوم، سيانيد الصوديوم، وهي مواد صلبة بلورية). يتفاعل حمض الهيدروسيانيك وأملاحه مع الكبريت الغروي أو المواد التي تطلقه لتشكل الثيوسيانات - وهي منتجات غير سامة.
من خلال التفاعل مع الألدهيدات والكيتونات، يشكل حمض الهيدروسيانيك وأملاحه سيانوهيدرينات منخفضة السمية.
تفاعلات أكسدة حمض الهيدروسيانيك وتفاعله مع الكبريت والألدهيدات والكيتونات تكمن وراء إزالة السموم من السم. يدخل السيانيد بسهولة في تفاعلات معقدة مع أملاح المعادن الثقيلة، على سبيل المثال، مع كبريتات الحديد والنحاس، والتي تستخدم في صناعة مادة ماصة كيميائية في أقنعة الغاز المرشحة.
عندما يتم استبدال ذرة الهيدروجين بالهالوجينات، يتم تشكيل السيانيدات المهلجنة السامة (سيانوكلوريد، بروميد السيانوجين، يودوسيانيوم).
الطريق الرئيسي لاختراق بخار حمض الهيدروسيانيك إلى الجسم هو الاستنشاق. لا يمكن استبعاد اختراق السم من خلال الجلد عندما يتم إنشاء تركيزات عالية (7-12 ملغم / لتر) من بخار حمض الهيدروسيانيك في الغلاف الجوي. من الممكن التسمم بحمض الهيدروسيانيك وأملاحه عند دخولها مع الماء أو الطعام الملوث. التركيز القاتل 2 ملجم/دقيقة/لتر.
عند تناوله عن طريق الفم، تكون الجرعات المميتة للإنسان هي: حمض الهيدروسيانيك - 1 ملغم / كغم، سيانيد الصوديوم - 2 ملغم / كغم، سيانيد البوتاسيوم - 3 ملغم / كغم.
أول أكسيد الكربون- غاز عديم اللون والرائحة. لديه كثافة هواء منخفضة (6.97)، ويسيل عند درجة حرارة - 191 درجة مئوية ويتجمد عند درجة حرارة - 204 درجة مئوية. وهو قابل للذوبان بشكل طفيف في الماء، ويفضل أن يكون ذلك في المذيبات العضوية. يتم امتصاص أول أكسيد الكربون بشكل سيء بواسطة أقنعة غاز مرشح الكربون، ولا تحمي جسم الإنسان من التسمم.
يحترق أول أكسيد الكربون بلهب أزرق مكونًا ثاني أكسيد الكربون. عند معالجة أول أكسيد الكربون بالكلور في الضوء أو في وجود الكربون المنشط، يتكون غاز الفوسجين. لا يمكن لأول أكسيد الكربون أن يدخل الجسم إلا من خلال الجهاز التنفسي. تختلف السمية وعلامات التسمم بشكل كبير من شخص لآخر؛ ويمكن أن يعزى ذلك إلى عوامل مثل الاختلافات في تبادل الغازات، والخصائص الفردية (العمر، والصحة، والحالة الجسدية والعقلية)، وما إلى ذلك.
بسبب العوامل العديدة التي تؤثر على التسمم بأول أكسيد الكربون، تتم مقارنة السمية وأعراض التسمم بمحتوى كربوكسي هيموغلوبين في الدم: تركيز أول أكسيد الكربون 5 ملغم/لتر مع التعرض لمدة 5-10 دقائق يعتبر قاتلاً (محتوى كربوكسي هيموغلوبين 70). %)، فإن التعرض لتركيز 2 ملغم/لتر لمدة ساعة واحدة يعد أمرًا خطيرًا.
مقدمة
التسمم بالكربون أول أكسيد الكربون السمية
أول أكسيد الكربون غدرا للغاية وليس له رائحة على الإطلاق. ويمكن أن يتشكل في أي مكان توجد فيه عملية احتراق، حتى في الفرن. السبب الرئيسي لتكوينه هو نقص الأكسجين في منطقة الاحتراق. وبعد ذلك، بدلاً من ثاني أكسيد الكربون غير الضار تمامًا - وهو نتاج الاحتراق الكامل للوقود - يتم تشكيل نفس أول أكسيد الكربون.
يمكن أن يحدث التسمم بأول أكسيد الكربون بهدوء شديد. لا يمكن معرفة وجود الغاز إلا بعد الشعور بالإعياء، وكمية قليلة منه تكفي للتسبب بالتسمم.
يمكن أن يحدث التسمم الحاد بثاني أكسيد الكربون في الإنتاج، وخاصة في الصناعة الكيميائية، أثناء فحم الكوك، وفي تعدين الفحم، والمسابك، عندما تتشكل كمية كبيرة من أول أكسيد الكربون أثناء عملية الإنتاج. لذلك، على سبيل المثال، يحتوي غاز الفحم المضيء على 4-11٪ من ثاني أكسيد الكربون، وغاز فحم الكوك - 70٪، والغاز الصخري - 17٪، وغاز المولدات من الفحم وفحم الكوك - 27٪، وغاز الفرن العالي - ما يصل إلى 30٪. تحتوي غازات عادم السيارات على نسبة 6.3% في المتوسط، وفي بعض الأحيان تصل إلى 13.5% من ثاني أكسيد الكربون. في كبائن السيارات، يمكن أن يصل تركيز ثاني أكسيد الكربون إلى 0.05 ملجم لكل 1 لتر من الهواء أو أكثر، وفي شوارع المدينة، اعتمادًا على الحمل المروري، من 0.004 إلى 0.21 ملجم / لتر، وبالقرب من السيارات - 1.5-7.1 ملجم / لتر . إن خطر التسمم بأول أكسيد الكربون في الكراجات كبير إذا لم يتم اتباع الاحتياطات (التهوية). لذلك، المحرك هو 20 حصان. مع. يمكن أن يطلق ما يصل إلى 28 لترًا من ثاني أكسيد الكربون في الدقيقة، مما يخلق تركيزًا قاتلاً للغاز في الهواء بعد 5 دقائق.
الخواص الفيزيائية والكيميائية والأهمية السمية لأول أكسيد الكربون (II)
أول أكسيد الكربون (II) - أول أكسيد الكربون، أول أكسيد الكربون. وهو غاز عديم اللون والرائحة يحترق بلهب أزرق وينتج ثاني أكسيد الكربون. عند امتزاجه بالهواء، ينفجر عند اشتعاله. يتم تشكيله أثناء الاحتراق غير الكامل للوقود أثناء صهر ومعالجة المعادن الحديدية وغير الحديدية. يوجد أول أكسيد الكربون (II) في غازات عادم محركات الاحتراق الداخلي ويتشكل أثناء عمليات التفجير والحرائق.
يتميز أول أكسيد الكربون بخصائص اختزالية واضحة؛ ويحتوي جزيئه على تكافؤين غير مشبعين () وبالتالي يمكنه إضافة سلسلة العناصر الكيميائية. وينبغي الإشارة في هذا الصدد إلى مركبات الكربونيل المعدنية السامة، مثل مركبات أول أكسيد الكربون مع النيكل والحديد، والتي تستخدم في الصناعة الكيميائية. عند دخول الكربونيل إلى الجسم، تطلق أول أكسيد الكربون:
ني(СО)4> ني + 4CO.
النيكل رباعي الكربونيل
يمكن أن يحدث تفاعل مماثل أيضًا عند تسخين مركبات الكربونيل، خاصة على الكربون المنشط والمواد المسامية الأخرى، وكذلك عند تعرضها لعوامل مؤكسدة قوية، مثل الكلور:
Fe(CO)5 + Cl2 > 5CO + FeCl2.
خماسي كربونيل الحديد
على الرغم من أن الأمر قد يبدو متناقضًا للوهلة الأولى، إلا أن أحد مصادر أول أكسيد الكربون هو الشخص نفسه، الذي ينتج جسمه ويطلق حوالي 10 مل من ثاني أكسيد الكربون في البيئة الخارجية (مع هواء الزفير) يوميًا. وهذا ما يسمى بأول أكسيد الكربون الداخلي، أي الذي يتشكل في البيئات الداخلية للجسم. وقد أظهر العديد من الباحثين أنه ينفصل عن جزيئات الهيموجلوبين عندما يتحول إلى البيليروبين الصباغ الصفراوي. البيليروبين له بنية خطية، والتي تتشكل بسبب انقسام رابطة الميثين بين حلقتين بيرول الهيم المتجاورتين. في هذه الحالة، يتم إطلاق جزيء ثاني أكسيد الكربون. نظرًا لأن البيليروبين يتكون ليس فقط من الهيموجلوبين، ولكن أيضًا من البروتينات المعدنية الأخرى (السيتوكروم، والميوجلوبين، والبورفيرين، وما إلى ذلك)، فإن الأخير يمكن أيضًا أن يكون مصدرًا لثاني أكسيد الكربون الداخلي. وبالتالي، فإن أول أكسيد الكربون هو نتاج عملية التمثيل الغذائي الطبيعي وإطلاقه من قبل البشر بيئةيشبه إزالة ثاني أكسيد الكربون والأمونيا والمركبات الكيميائية الأخرى التي تتشكل أثناء عملية التمثيل الغذائي من الجسم.
على الرغم من أن المعلومات الأولى عن وجود ثاني أكسيد الكربون الداخلي ظهرت في الأدبيات منذ حوالي 85 عامًا، إلا أنه في العقود الأخيرة فقط بدأت هذه الحقيقة تحظى بأهمية كبيرة، وهو ما يرجع في المقام الأول إلى الحاجة إلى توفير بيئة هوائية طبيعية للمتخصصين الذين يقضون فترات طويلة من الوقت في غرف مغلقة (كبائن الطائرات والمركبات الفضائية، والغواصات، وما إلى ذلك). في مثل هذه الظروف يضطر الشخص إلى استنشاق الهواء الذي يتراكم فيه أول أكسيد الكربون الداخلي، وهذا يمكن أن يسبب التسمم الذاتي. ولمنع مثل هذه الظاهرة الخطيرة، من الضروري استخدام أجهزة خاصة لامتصاص أول أكسيد الكربون.
يمثل التسمم بأول أكسيد الكربون أكثر من 17% من إجمالي حالات التسمم. أنواعها الرئيسية هي:
التسمم بأول أكسيد الكربون (II) الموجود في غازات عادم السيارات والمركبات الأخرى. يتم ملاحظتها عند الأشخاص الذين يقيمون في المرائب المغلقة والسيارات التي يعمل المحرك فيها لفترة طويلة (غالبًا في فصل الشتاء).
التسمم الناتج عن الحرق في المنزل في غرف ذات تدفئة خاطئة وفي غرف الغلايات بالمباني المنزلية والصناعية.
التسمم أثناء حرائق الأشخاص في المباني والمباني المليئة بالدخان (الغرف المغلقة والشقق) وفي سيارات النقل والمصاعد.
تختلف حساسية الأشخاص من مختلف الفئات العمرية تجاه أول أكسيد الكربون. يكون الأطفال حديثي الولادة أكثر مرونة ويمكنهم تحمل مستويات أول أكسيد الكربون (II) في الهواء والتي تكون مميتة للبالغين.
آلية العمل السام لأول أكسيد الكربون (II)
يخترق أول أكسيد الكربون الرئتين بالهواء الجوي، ويتغلب بسرعة على الغشاء الشعري السنخي، ويذوب في بلازما الدم، وينتشر في خلايا الدم الحمراء ويدخل في تفاعل كيميائي عكسي مع كل من الهيموجلوبين المؤكسد والمخفض وفقًا للمخطط التالي:
Hb2 + CO HbCO + O2
أو Hb + CO HbCO .
إن مركب كربوكسي هيموغلوبين المعقد المرضي (HbCO) غير قادر على ربط الأكسجين بنفسه. في هذه الحالة، في جزيء الهيموجلوبين، يتحد ثاني أكسيد الكربون مع ذرات الحديد (الكربونيل)، مما يؤدي إلى إزاحة الأكسجين. من الواضح أن جزيء هيموغلوبين واحد (بتعبير أدق، 4 من هيمه) يمكنه ربط ما يصل إلى 4 جزيئات من ثاني أكسيد الكربون.
يمتص الدم أول أكسيد الكربون بشكل مكثف للغاية بسبب ارتباطه الكيميائي العالي بالهيموجلوبين. اتضح أن أول أكسيد الكربون يرتبط بالهيموجلوبين بشكل أكثر نشاطًا بحوالي 250 مرة من الأكسجين. بمعنى آخر، في المنافسة على الهيموجلوبين، يتمتع أول أكسيد الكربون بميزة واضحة على الأكسجين. تظهر الحسابات أنه عندما يحتوي الهواء على 0.07% CO و21% O2، فإن كمية HbO2 المتكونة في الدم تصبح مساوية لكمية HbCO. يمكن إنشاء مثل هذا التوازن إذا تم الحفاظ على تركيز أول أكسيد الكربون في الهواء الذي يستنشقه الشخص بالقرب من 0.07٪ لعدة ساعات (وفقًا لبعض المصادر، لعدة أيام). ولهذا السبب فإن الكميات الصغيرة من أول أكسيد الكربون، بما في ذلك أول أكسيد الكربون الداخلي، يمكن أن تكون خطيرة إذا تعرضت للجسم لفترات طويلة من الزمن في أماكن ضيقة. ويجب أن نضع في اعتبارنا أيضًا أن تفكك كربوكسي هيموغلوبين يحدث ببطء شديد (أبطأ بـ 3500 مرة من تفكك أوكسي هيموغلوبين)، وهذا يساهم أيضًا في تراكمه في الدم.
كلما زاد تركيز ثاني أكسيد الكربون في الهواء، تم الوصول بشكل أسرع إلى محتوى الكربوكسي هيموجلوبين الذي يهدد الحياة في الدم، والذي يبلغ 50٪ أو أكثر بالنسبة لجميع الهيموجلوبين (الشكل 1). يتم عادةً تقييم العلاقة بين كمية HbCO وHbO2 في الدم، من ناحية، وتركيزات CO وO2 في الهواء المستنشق، من ناحية أخرى، باستخدام ثابت دوغلاس:
وتبين هذه القيمة، والتي تسمى أيضًا معامل التسمم، أن كمية الكربوكسي هيموجلوبين المتكونة تتناسب طرديًا مع الضغط الجزئي لأول أكسيد الكربون وتتناسب عكسيًا مع الضغط الجزئي للأكسجين. من ناحية أخرى، كلما زاد الأكسجين في الهواء المستنشق (وبالتالي في مجرى الدم)، قل تكوين HbCO وأصبح تفككه أسرع.
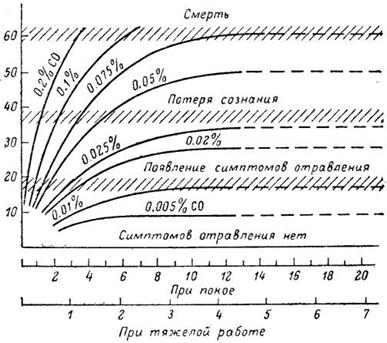
أرز. 1. مخطط سمية أول أكسيد الكربون (فرانك، 1973). الإحداثي هو محتوى HbCO في الدم، المجلد. %؛ المحور س - الوقت، ح
وفقًا لمؤلفين مختلفين، تتراوح قيمة K لدم الإنسان من 204 إلى 279، أي أن معدل تكوين HbCO أكبر بعدة مرات من معدل تكوين أوكسي هيموغلوبين HbO2 Tiunov L. A., Kustov V, V. علم سموم أول أكسيد الكربون . م: الطب، 1980. ومع ذلك، بالإضافة إلى الضغط الجزئي، فإن شدة امتصاص أول أكسيد الكربون عن طريق الدم تعتمد أيضًا على مدة تأثيره على الجسم وكمية التهوية الرئوية (حجم التنفس الدقيق). وفي هذا الصدد، فإن الصيغة التي اقترحها ليلينتال (1946) ذات أهمية خاصة:
% НbСО = PCO*t*v*0.05,
حيث pCO هو الضغط الجزئي لأول أكسيد الكربون بالملم زئبق. فن.؛ ر - وقت التعرض بالدقائق؛ v هو الحجم الدقيق للتنفس، أي حاصل ضرب عمق الشهيق باللتر في عدد الأنفاس في الدقيقة الواحدة.
يتباطأ Hb + O2) وبالتالي يتناقص إمداد الأكسجين إلى الخلايا بشكل أكبر. هذا هو السبب في أن HbCO، بينما يقلل من امتصاص الأكسجين في الرئتين عن طريق الدم، فإنه في نفس الوقت يجعل من الصعب تفريغ HbO2 في الأنسجة. على ما يبدو، هذا تفسير لحالات التسمم الشديد بكمية صغيرة نسبيًا من HbCO في الدم (تصل إلى 30٪).
وبما أن الألفة الكيميائية للحديدوز هي السبب الرئيسي لتفاعل أول أكسيد الكربون مع الهيموجلوبين، فيمكن الافتراض أن الكروموبروتينات الأخرى التي تحتوي على أيونات Fe2+ في جزيئاتها يجب أن تتفاعل مع هذا السم. الآن لم يعد هناك شك في أن هذا النوع من التفاعل يمكن أن يؤثر بشكل كبير على مسار التسمم. هناك الكثير من البيانات التجريبية التي تبين أن التسمم الحاد بأول أكسيد الكربون يصاحبه اضطراب في عمليات استهلاك الخلايا للأكسجين. أساس هذه الاضطرابات هو في المقام الأول منع الإنزيمات المحتوية على الحديد - السيتوكروم وأكسيداز السيتوكروم - بالسم. وبالتالي، عند التعرض لثاني أكسيد الكربون، يضاف نقص الأكسجة في الأنسجة إلى نقص الأكسجة في فصيلة الدم، مما يزيد من تفاقم مسار التسمم بأول أكسيد الكربون. لدى الشخص المسموم علامات على زيادة الضرر الذي يلحق بالجهاز العصبي المركزي: الصداع، والدوخة، وضعف التنسيق بين الحركات والمجال المنعكس، بالإضافة إلى عدد من التغييرات في النشاط العقلي، التي تذكرنا بتسمم الكحول (النشوة، وفقدان ضبط النفس، والغضب غير المناسب). الأفعال، الخ). احمرار الجلد المصاب هو سمة. عندما تتجاوز كمية HbCO في الدم 50-60٪، تحدث تشنجات، ويفقد الوعي، وإذا لم يتم اتخاذ تدابير الطوارئ، فقد يموت الشخص بسبب توقف التنفس والقلب.
تظهر أعراض التسمم بتركيزات مختلفة من كربوكسي هيموجلوبين (HbCO) في الدم في الجدول 1.
الجدول 1

يتأثر مسار التسمم بأول أكسيد الكربون بالعوامل التالية:
يمنع الكحول الإيثيلي تشبع الدم بأول أكسيد الكربون (II)، وكلما زادت نسبة الكحول في الدم، انخفضت نسبة تكوين HbCO.
يمكن أن يعزز حمض الهيدروسيانيك التأثير السام لأول أكسيد الكربون (II). يتم إطلاق حمض الهيدروسيانيك أثناء احتراق الصوف والبوليمرات والمواد الاصطناعية (في الحرائق).
تعمل أكاسيد النيتروجين (II و IV) على تعزيز التأثير السام لأول أكسيد الكربون (II).
في حالة التسمم، توجد أكبر كميات من أول أكسيد الكربون (II) في الجيوب الأنفية للسحايا وأوعية الفخذ والكتف. يتم التخلص من أول أكسيد الكربون (II) من الجسم عبر الجهاز التنفسي بنسبة 60-70% خلال ساعة واحدة، وبنسبة 90-96% خلال 4 ساعات.
أهداف البحث: الدم والعضلات (نادرا).
كشف وتحديد أول أكسيد الكربون (II)
يتم الكشف وتحديد أول أكسيد الكربون (II) مباشرة في الدم. لهذا الغرض، يتم استخدام طرق التحليل الكروماتوغرافي الغازي والكيميائي والطيفي والطيفي.
طريقة الكروماتوغرافيا الغازية
تعتمد هذه الطريقة على تقدير أول أكسيد الكربون (II) باستخدام تحليل مساحة الرأس. ويتم الكشف مباشرة في الطور الغازي أو بعد الاختزال إلى الميثان أو الأكسدة إلى أول أكسيد الكربون (IV).
النسخة الأولى من الطريقة. تتم إضافة كربونات الصوديوم أو بيكربونات الصوديوم إلى الدم. يدخل أول أكسيد الكربون (II) إلى الطور الغازي. يتم إخراجها بحقنة وحقنها في جهاز الكروماتوجراف. يتم استخدام كاشف التوصيل الحراري (katarometer). ويستند الكشف على وقت الاحتفاظ. يتم حساب تركيز أول أكسيد الكربون (II) من رسم بياني للمعايرة يعبر عن اعتماد منطقة الذروة على تركيز أول أكسيد الكربون (II). في هذا النموذج، يمكن تحديد أول أكسيد الكربون (II) في الدم عندما يكون محتواه 30-100%. خطأ الطريقة هو 10٪.
خيار الطريقة الثانية. يتم عزل أول أكسيد الكربون (II) من الدم كما في الخيار الأول. يتم إدخال مرحلة الغاز في موزع الجهاز. يوصى باستخدام الهيليوم كغاز حامل، والذي يزيح ثاني أكسيد الكربون من الموزع وينقله إلى عمود كروماتوغرافي مع محفز النيكل في INZ-600. تحت تأثير الهيدروجين، يتم تقليل ثاني أكسيد الكربون إلى غاز الميثان (CH4)، والذي يتم تسجيل ظهوره في النظام بواسطة كاشف تأين اللهب (FID). وميزة هذه الطريقة هي حساسيتها العالية وقدرتها على إجراء التحليل بعينات صغيرة من الدم (0.1 مل).
يعتمد الإصدار الثالث من الطريقة أيضًا على استخدام تحليل مساحة الرأس. تحتوي مرحلة الغاز البخاري على خليط من ثاني أكسيد الكربون وثاني أكسيد الكربون من أصل داخلي. يُستخدم عمود هلام السيليكا لفصل أول أكسيد الكربون (IV) وأول أكسيد الكربون (II). يتم تسجيل هذا الفصل بواسطة الكاشف. يتم بعد ذلك أكسدة أكسيد الكربون (II) في خلية خاصة بواسطة أكسيد اليود (V) إلى أكسيد الكربون (IV)، ويتم تسجيل الكمية الإجمالية لثاني أكسيد الكربون. يتم تحديد تركيز أول أكسيد الكربون (II) من خلال الفرق بين القمم التي تم الحصول عليها لثاني أكسيد الكربون الداخلي والكمية الإجمالية لثاني أكسيد الكربون.
طريقة الانتشار الدقيق
تتم إضافة 1 مل من الدم و1 مل من محلول حمض الكبريتيك 10% إلى الحجرة الخارجية للجهاز. يتم وضع 2 مل من محلول 0.1٪ من كلوريد البلاديوم في محلول 0.1 م من حمض الهيدروكلوريك في الغرفة الداخلية. يتم إغلاق الجهاز بغطاء ويترك لمدة ساعة واحدة درجة حرارة الغرفة. عند وجود أول أكسيد الكربون (II) في الدم، تظهر طبقة فضية من معدن البلاديوم في الغرفة الداخلية.
الطريقة الكيميائية
تعتمد هذه الطريقة على حقيقة أن أول أكسيد الكربون (II) يشكل مادة قوية إلى حد ما مركب كيميائيالذي يتفاعل بشكل سيئ مع الكواشف الأخرى.
الكشف عن كربوكسي هيموجلوبين الطريقة الكيميائيةفي حالة التسمم، يتم تنفيذه مباشرة في الدم باستخدام الكواشف المختلفة. للمقارنة، استخدم دم الحيوانات أو الجهات المانحة (عينة المراقبة)، والتي يتم إجراء نفس الاختبارات عليها (الجدول 2).
الجدول 2
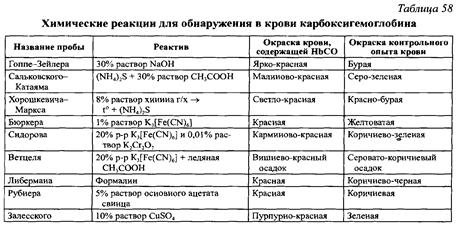
يتم ملاحظة تغير اللون من خلال مقارنة عينات التحكم والاختبار بعد إضافة الكواشف المختلفة. الدم المحتوي على كربوكسي هيموغلوبين لا يتغير أو يتغير لونه قليلاً بسبب إضافة الكواشف الكيميائية.
يتم إعطاء استنتاج حول اكتشاف كربوكسي هيموجلوبين في الدم إذا تم الحصول على النتائج الموضحة في الجدول باستخدام غالبية الكواشف.
يجب أن يؤخذ في الاعتبار أنه مع درجة خفيفة من التسمم ومحتوى منخفض من الكربوكسي هيموغلوبين، قد يتم الحصول على نتيجة سلبية.
الطريقة الطيفية
طريقة أخرى تستخدم للكشف عن الكربوكسي هيموجلوبين في الدم أثناء التسمم بأول أكسيد الكربون. في ممارسة التحليل السمي الكيميائي لهذه الأغراض، يتم استخدام المجهر المجهري - وهو مطياف متصل بالعدسة العينية. تعتمد الطريقة على قدرة الهيموجلوبين ومشتقاته على امتصاص الإشعاع الضوئي بطول موجي معين. إذا مر شعاع من الضوء عبر محلول يحتوي على الهيموجلوبين ومشتقاته، تظهر حزم امتصاص داكنة في الطيف.
يكشف الدم المخفف الذي لا يحتوي على كربوكسي هيموجلوبين، عند ملاحظته بالمنظار الطيفي، عن نطاقي امتصاص. وهي تقع بين خطوط فراونهوفر D وE في الأجزاء الصفراء والخضراء من الطيف، والتي تتوافق مع أوكسي هيموغلوبين. إذا تمت إضافة عامل الاختزال (NH4)2S إلى الدم، فسيتم تقليل الأوكسي هيموغلوبين إلى الهيموجلوبين. في هذه الحالة، بدلاً من نطاقي الامتصاص، سيتم ملاحظة نطاق عريض واحد في نفس المنطقة الطيفية. في الدم المخفف المرسل للتحليل السمي الكيميائي مع التسمم بأول أكسيد الكربون المشتبه فيه، سيتم أيضًا ملاحظة نطاقي امتصاص داكنين (الشكل 2).

أرز. 2. الكشف عن كربوكسي هيموجلوبين بواسطة التحليل الطيفي
عند إضافة (NH4)2S إلى هذا الدم، لا يحدث أي اختزال. لا تختفي نطاقات الامتصاص. وهذا يدل على المقاومة الكيميائية العالية للكربوكسي هيموجلوبين. ومع ذلك، بين هذه النطاقات المحددة بوضوح، غالبا ما يظهر سواد طفيف بسبب حقيقة أن أوكسي هيموغلوبين غير المرتبط بأول أكسيد الكربون يتحول إلى الهيموجلوبين.
في حقوق المخطوطة
تيتوف دينيس نيكولايفيتش
القواعد الفيزيائية والكيميائية للتشكيل والآليات
إجراءات محفز الأكسدة في درجة الحرارة المنخفضة
أكسيد الكربون (II) في نظام PdCl2 - CuCl2/-Al2O3
التخصص 02.00.04. - الكيمياء الفيزيائية
خلاصة
أطروحة للحصول على الدرجة العلمية لمرشح العلوم الكيميائية موسكو 2010 تم تنفيذ العمل في قسم التكنولوجيا الكيميائية العامة التابع لأكاديمية موسكو الحكومية للتكنولوجيا الكيميائية الدقيقة التي سميت باسمها.م.ف. لومونوسوف المشرف العلمي:
دكتوراه في العلوم الكيميائية بروك ليف غريغوريفيتش المعارضين الرسميين:
دكتور في العلوم الكيميائية تريتياكوف فالنتين فيليبوفيتش مرشح العلوم الكيميائية ميخائيل يوريفيتش سينيف المنظمة الرائدة:
معهد الكيمياء العضوية الذي يحمل اسمه. اختصار الثاني. Zelinsky RAS سيتم الدفاع عن الأطروحة في 29 ديسمبر 2010 الساعة 15-00 في اجتماع لمجلس الأطروحة D 212.120.05 في المؤسسة التعليمية الحكومية الفيدرالية للتعليم المهني العالي "أكاديمية موسكو الحكومية للتكنولوجيا الكيميائية الدقيقة التي سميت باسمها". .
م.ف. لومونوسوف" على العنوان: 119571، موسكو، شارع فيرنادسكي، 86، غرفة. م-119.
119571، موسكو، شارع فيرنادسكوغو، 86، MITHT im. م.ف. لومونوسوف.
يمكن العثور على الأطروحة في مكتبة أكاديمية موسكو الحكومية للتكنولوجيا الكيميائية الدقيقة التي سميت باسمها. م.ف.
لومونوسوف على العنوان: 119571، موسكو، شارع فيرنادسكوغو، 86.
السكرتير العلمي لمجلس الأطروحة مرشح العلوم الكيميائية /Efimova Yu.A./
وصف عام للعمل
الملاءمة إن تفاعل أكسدة أول أكسيد الكربون (II) مع الأكسجين عند درجة حرارة منخفضة له أهمية علمية أساسية، لأنه أحد أبسط تفاعلات الأكسدة ويمكن استخدامه كنموذج لتوضيح الأنماط العامة لعمليات الأكسدة. بالإضافة إلى ذلك، فإن دراسة هذا التفاعل مثيرة للاهتمام عمليا، حيث أن أول أكسيد الكربون (II) هو أحد المواد السامة التي تدخل الهواء نتيجة الكوارث الطبيعية (الحرائق والانفجارات البركانية) والنشاط البشري (انبعاثات الغاز من المؤسسات الصناعية والطرق ينقل). تُستخدم أجهزة التنفس والأغطية الواقية وأقنعة الغاز لحماية الأشخاص في حالات الطوارئ من أول أكسيد الكربون.الجزء الوظيفي من هذه الأجهزة هو محفز لأكسدة أول أكسيد الكربون. ضمن محفزات درجات الحرارة المنخفضةأقل مجموعة من المحفزات التي تمت دراستها والمستخدمة لتنفيذ هذا التفاعل هي المحفزات المعقدة المعدنية المدعومة. وأكثر هذه المجموعة الواعدة هي المحفزات القائمة على مركبات البلاديوم والنحاس. من الضروري دراسة طبيعة المراكز النشطة وآلية التفاعل التي تتضمن هذه المحفزات، حيث أن البيانات المتاحة عن حالة المكونات النشطة على سطح الدعامة والآلية التفصيلية للعملية التحفيزية مجزأة ومتناقضة.
أهداف هذا العمل هي تحسين المحفز المركب المعدني المعتمد على البلاديوم وكلوريدات النحاس.
الحصول على بيانات حول التركيب والبنية وتكوين المراكز النشطة وآلية تفاعل أكسدة أول أكسيد الكربون مع الأكسجين في درجة حرارة منخفضة على محفز معقد معدني مدعوم PdCl2-CuCl2/-Al2O3.
الجدة العلمية تم تأكيد الإمكانية الأساسية لاستخدام أكسيد التيتانيوم في التعديلات البلورية المختلفة كحامل لإعداد محفز لأكسدة أول أكسيد الكربون في درجات الحرارة المنخفضة مع الأكسجين الجوي.
تم تطوير تقنية لتعديل نظام PdCl2-CuCl2/-Al2O3 بشكل فعال مع أكاسيد الفضة (I)، والنحاس (II)، والحديد (III)، مما يؤدي إلى زيادة النشاط التحفيزي واستقرار هذا النظام في ظل الظروف. أكسدة أول أكسيد الكربون عند درجة حرارة منخفضة.
باستخدام التحليل الطيفي لامتصاص الأشعة السينية (XANES/EXAFS)، وقياس حيود مسحوق الأشعة السينية، والمجهر الإلكتروني الماسح، تبين أن البيئة المحلية للنحاس أثناء تحضير المحفز تتغير من رباعي هرمي مخلوط بالأكسجين والكلور في CuCl2* 2H2O من خلال الأكسجين رباعي الهرمي في محلول مائي من كلوريد النحاس (II) إلى بيئة أكسجين غير منتظمة تمامًا مع تفاعلات Cu…Cl الثانوية في بنية Cu2Cl(OH)3 (باراتاكاميت) المتكونة على سطح -Al2O3. لا تتغير بيئة التنسيق للبلاديوم (مربع مسطح من ذرات الكلور) عند التحول من كلوريد البلاديوم (II) الصلب (-تعديل) إلى محلول مائي يحتوي، بالإضافة إلى كلوريد البلاديوم (II)، كلوريد النحاس (II)، وإلى الحالة على السطح -Al2O3 باستثناء استطالة رابطة واحدة من كلور البلاديوم. لا تتغير درجة أكسدة ذرات البلاديوم والنحاس أثناء تحضير المحفز.
باستخدام التحليل الطيفي للأشعة تحت الحمراء لتحويل فورييه المنتشر، تبين أنه في وجود بخار الماء وأول أكسيد الكربون، يتم تنسيق أول أكسيد الكربون (II) على سطح المحفز مع تكوين مجموعات الكربونيل الطرفية والسد.
يحدث تحويل مجموعات الكربونيل إلى ثاني أكسيد الكربون بمشاركة الأكسجين.
باستخدام أساليب XANES/EXAFS في الموقع، ثبت أنه في جو N2 + CO بدون H2O وO2، لا تحدث تغييرات مهمة في الأطياف عند Cu K-edge وPd K-edge لفترة طويلة.
تؤدي إضافة بخار الماء إلى تقليل Pd(II) وظهور مجمعات Pd(I) ذات رابطة Pd-Pd، أي أن امتزاز الماء يعزز اختزال Pd(II).
بناءً على جميع البيانات التي تم الحصول عليها، تم اقتراح آلية لتشكيل المركز النشط للتحفيز وآلية تفاعل أكسدة أول أكسيد الكربون في درجات الحرارة المنخفضة مع الأكسجين على محفز معقد معدني مدعوم PdCl2-CuCl2/-Al2O3.
الأهمية العملية تم تطوير طريقة لاختبار المحفزات المسحوقة في وضع التميع القسري.
تم إثبات إمكانية استخدام التعديلات البلورية لثاني أكسيد التيتانيوم كحامل لتحضير المحفزات، كما تم إثبات جدوى تعديل نظام PdCl2-CuCl2/-Al2O3 باستخدام أكاسيد الفضة (I)، والنحاس (II)، والحديد. الثالث) قد تبين. وهذا يوسع إمكانيات تطوير محفزات فعالة لأكسدة الركائز المختلفة بالأكسجين.
تم تقديم نتائج أعمال البحث للدفاع عن المحفز المعقد المعدني المعتمد على البلاديوم وكلوريدات النحاس.
- نتائج دراسة حالة المكونات النشطة لمحفز طازج PdCl2-CuCl2/-Al2O أكسدة أول أكسيد الكربون (II) عند درجة حرارة منخفضة - آلية تكوين المركز النشط تحت ظروف التفاعل على هذا المحفز.
آليات التفاعل المقترحة بناءً على البيانات التي تم الحصول عليها من مجمعات البلاديوم والنحاس على سطح أكسيد الألومنيوم والاعتماد الحركي الجزئي لمعدل تكوين ثاني أكسيد الكربون على الضغوط الجزئية للأكسجين والماء.
الموافقة على العمل تم الإبلاغ عن النتائج الرئيسية للعمل في المؤتمر الروسي الثالث "المشاكل الحالية للكيمياء الفيزيائية" بمشاركة دولية (زفينيجورود، 2009)، والمدرسة العلمية لعموم روسيا للشباب "المشاكل الحالية للكيمياء الفيزيائية الحديثة"
(موسكو، 2009)، المؤتمر العلمي والتقني الثالث للشباب "التقنيات الكيميائية عالية التقنية - 2009" (موسكو، 2009)، المؤتمر العلمي والتقني للشباب " قضايا معاصرةالتحفيز وتكرير النفط" (موسكو، 2010)، وكذلك في إطار المدرسة الصيفية "تكثيف العمليات وتصميم التفاعلات الحفزية" في المعهد الفيدرالي جامعة فنية(لوزان، سويسرا، 2010).
نطاق وهيكل العمل يتكون عمل الأطروحة من مقدمة ومراجعة الأدبيات والجزء التجريبي ومناقشة النتائج والاستنتاجات والببليوغرافيا. يُعرض العمل على صفحات من النص المطبوع ويحتوي على رسوم بيانية ورسومات وجداول. تتضمن قائمة الأدبيات المذكورة العناوين.
المساهمة الشخصية لمقدم الطلب أكمل مرشح الأطروحة النطاق الكامل للبحث التجريبي حول تخليق واختبار المحفزات الجديدة لأكسدة أول أكسيد الكربون (II) في درجات الحرارة المنخفضة، وطور طريقة لاختبار التركيبات الحفزية المشتتة بدقة، وحصل على جزئية الاعتماد الحركي لمعدل تكوين أول أكسيد الكربون (IV) على الضغوط الجزئية للماء والأكسجين على المحفز PdCl2 -CuCl2/-Al2O3. شارك مقدم الطلب بشكل مباشر في دراسة عينات المحفز باستخدام الطرق الفيزيائية ومعالجة النتائج.
تثبت المقدمة أهمية موضوع الأطروحة واختيار موضوع الدراسة، وتصوغ أهداف العمل.توفر مراجعة الأدبيات (الفصل الأول) بيانات من مؤلفين محليين وأجانب حول المحفزات المتاحة لأكسدة أول أكسيد الكربون (II) في درجات الحرارة المنخفضة، وعن آليات التفاعل على أنواع مختلفة من المحفزات، وعن حالة المكونات النشطة للمحفزات التي تشمل البلاديوم على مجمعات الكربونيل من البلاديوم والنحاس. أظهر تحليل بيانات الأدبيات أن المعلومات المتاحة عن حالة المكونات النشطة على سطح الدعم والآلية التفصيلية للعملية التحفيزية على المحفزات المعقدة المعدنية المدعومة القائمة على مركبات البلاديوم والنحاس مجزأة ومتناقضة.
يوفر الفصل الثاني ("طرق إجراء التجارب والتحليلات ومعالجة النتائج") طرقًا لإعداد واختبار النشاط التحفيزي للعينات وإجراء التجارب الحركية ووصفًا للأدوات وطرق وشروط الحصول على البيانات بالطرق الفيزيائية *.
تمت دراسة ثلاث عينات بشكل رئيسي بالطرق الفيزيائية.
كانت العينة 1 عبارة عن جزء -Al2O3 (GOST 8136-85) بحجم جسيم يبلغ 0.5 1 مم (مساحة السطح تحددها طريقة BET، 219 م2/جم). تم استخدام العينة 1 كحامل لتحضير العينات 2 و3. تم تحضير العينة 2 (CuCl2/-Al2O3) والعينة (المحفز، PdCl2-CuCl2/-Al2O3) عن طريق التشريب البارد للعينة 1 بمحلول مائي من CuCl2 (CuCl2*2H2O، GOST 4167-61) ومحلول مائي من الأملاح PdCl2 (PdCl2، TU 2625-048-00205067-2003) وCuCl2، على التوالي. تركيبة المحفز هي 1.5% Pd، 3.5% Cu من وزن الدعامة. كان محتوى CuCl2 في المحلول المستخدم لتحضير العينات 2 و3 هو نفسه. تم تسجيل أطياف امتصاص الأشعة السينية XANES/EXAFS عند حواف امتصاص K للنحاس والبلاديوم للعينتين 2 و3، وكذلك للمركبات المرجعية CuCl2*2H2O(s) وPdCl2(s) ومحاليلها المائية، المطابقة لـ تلك المستخدمة لتشريب الدعامة أثناء تحضير العينة. تمت دراسة العينات بواسطة قياس حيود الأشعة السينية المسحوقية باستخدام إشعاع السنكروترون.
تم استخدام لوحات FujiFilm ImagingPlate الحساسة للضوء ككاشف ثنائي الأبعاد؛ تم إجراء رقمنة أنماط الحيود باستخدام قارئ FujiFilm BAS-5000 بخطوة مكانية قدرها ميكرومتر. كان الطول الموجي للإشعاع =0.46416، وكانت المسافة بين العينة والكاشف 230 ملم، ومدة التعرض 30 دقيقة.
تم إجراء المعالجة الأولية لأنماط الحيود ثنائية الأبعاد باستخدام برنامج Fit2D.
المؤلف ممتن للدكتوراه. باحث كبير موافق. زوبافيكوس، باحث أ.أ. Veligzhanin (مركز البحوث الإقليمية "معهد كورشاتوف"، محطة "علوم المواد الإنشائية") لدراسة العينات باستخدام التحليل الطيفي لامتصاص الأشعة السينية (EXAFS/XANES)، وقياس حيود الأشعة السينية المسحوقية باستخدام إشعاع السنكروترون، دكتوراه في العلوم الكيميائية. البروفيسور جي إم. Kuzmicheva (MITHT) لإجراء دراسة لعدد من العينات باستخدام قياس حيود مسحوق الأشعة السينية، وكذلك لتقديم عينات من أنابيب الكربون النانوية وأكسيد التيتانيوم (IV)، دكتوراه. باحث رائد
ن.ف. Sadovskaya (FSUE "NIFHI يحمل اسم L.Ya. Karpov"، مختبر "الكيمياء الفيزيائية وتشخيص الأفلام") لدراسة العينات باستخدام المجهر الإلكتروني الماسح، دكتوراه في العلوم الكيميائية. O.P. تكاتشينكو، دكتوراه في العلوم الكيميائية إل إم. Kustov (معهد الكيمياء العضوية الذي يحمل اسم N.D. Zelinsky RAS) لدراسة العينات باستخدام مطيافية IR-Fourier (DRIFT)، دكتوراه. على ال. Prokudina لقياس المساحة السطحية النوعية لـ -Al2O3 (MITHT)، دكتوراه في العلوم الكيميائية. البروفيسور أ. Katsman للمساعدة في معالجة البيانات الحركية (MITHT)، طالب الدراسات العليا A.V. Ustyugov (MITHT) للمساعدة في إجراء التجارب الحركية. المؤلف ممتن للدكتوراه. أستاذ مشارك ك.يو. Odintsov لإنشاء برنامج لمعالجة البيانات الحركية.
تم إجراء دراسة حالة وبنية مكونات النظام الحفاز من خلال دراسة البنية الدقيقة لحافة امتصاص الأشعة السينية (XANES) ومن خلال دراسة البنية الدقيقة التذبذبية الممتدة لحافة امتصاص الأشعة السينية (EXAFS) . تم الحصول على أطياف امتصاص الأشعة السينية XANES/EXAFS عند حواف الامتصاص K للنحاس والبلاديوم. تم تحقيق اللون الأحادي لحزمة إشعاع السنكروترون باستخدام غرف تأين أحادية اللون Si (111) مملوءة بالنيتروجين (Cu K-edge) أو الأرجون (Pd K-edge) ككاشفات. لمعالجة أطياف EXAFS، تم استخدام حزمة البرامج IFEFFIT وتم حساب سعة ومراحل تشتت الإلكترون الضوئي باستخدام برنامج FEFF.
تمت دراسة البنية المجهرية للعينات عن طريق المجهر الإلكتروني الماسح (SEM) باستخدام المجهر الإلكتروني الماسح دقة عاليةمع كاثود الانبعاث الميداني 7500 فهرنهايت من JEOL (اليابان). تم التقاط الصور في وضع الإلكترون الثانوي منخفض الطاقة.
بالإضافة إلى ذلك، تم استخدام وضع Gentle Beam لتسريع الفولتية 1 و2 كيلو فولت (400 فولت على سطح العينة).
تم إجراء دراسة العينات عن طريق التحليل الطيفي للأشعة تحت الحمراء فورييه المنتشر باستخدام جزيئات المسبار (DRIFT) على مطياف NICOLET "Protege" 460، المجهز بمقياس طيفي تم تطويره في معهد الكيمياء العضوية. اختصار الثاني. Zelinsky RAS مع مرفق انعكاس منتشر، في حدود 6000-400 سم بخطوة 4 سم، للحصول على نسبة إشارة إلى ضوضاء مرضية، تم جمع 500 طيف. في تجربة لدراسة المحفز في ظل ظروف تفاعل أكسدة أول أكسيد الكربون (II)، تم تجميع 50 طيفًا في نطاق عددي موجي قصير (2450-1700 سم-1). تم استخدام مسحوق CaF2 كمعيار.
قبل قياس الأطياف، تمت معالجة العينات 1-3 في الفراغ عند درجة حرارة الغرفة لمدة 4 ساعات لإزالة الماء الممتص فعليًا. تم استخدام أول أكسيد الكربون كجزيء اختبار. تم إجراء الامتزاز عند درجة حرارة الغرفة وضغط توازن ثاني أكسيد الكربون قدره 20 مم زئبق.
تم إجراء اختبار عينات النشاط التحفيزي في مفاعل التدفق الزجاجي الذي تم تزويده بخليط الغاز والهواء (GAM) الذي يحتوي على أول أكسيد الكربون بسرعة معينة.
تم قياس معدل إمداد DHW باستخدام عداد الغاز GSB-400.
تم تحديد تركيز ثاني أكسيد الكربون في الغاز المصدر والغاز بعد المفاعل باستخدام محلل غاز المستشعر PKG-4-SO-MK-S (TU4215-004، المجهز بمستشعر كهروكيميائي. البيانات المتعلقة بمحتوى ثاني أكسيد الكربون في النسخة الأصلية والمنقاة تم استخدام الماء الساخن لحساب درجة تحويل ثاني أكسيد الكربون. تم إجراء التجارب عند نسبة معينة من رطوبة DHW () ودرجة الحرارة (T)، والتي تم التحكم فيها باستخدام جهاز IVTM-7-03-03-01 (TU4311-001-). 29359805-01).
تمت دراسة الأنماط الحركية في مفاعل تدفق زجاجي منظم الحرارة تحت ظروف ثابتة عند درجة حرارة الماء الساخن وفي طبقة محفزة تبلغ 27 درجة مئوية، مع تحويل أكسيد الكربون (II) أقل من 15٪. تم حساب معدل تكوين ثاني أكسيد الكربون بناءً على قياسات تدفق الغاز وتكوينه (محتوى ثاني أكسيد الكربون) بعد المحفز.
تم تحديد تكوين الغاز عند المدخل وتكوين الغاز عند المخرج بواسطة تحليل كروماتوجرافي للغاز. وبتغيير الضغط الجزئي للماء (PH2 O) والأكسجين (PO2)، تم تغيير الضغط الجزئي للنيتروجين مع الحفاظ على الضغط الكلي والضغط الجزئي لأول أكسيد الكربون (II) وجميع العوامل الأخرى ثابتة. تمت معالجة التبعيات الحركية باستخدام برنامج المؤلف K.Yu. Odintsov وحزمة برامج المؤلف "Kinetics" E.A. كاتسمان.
ويعرض الفصل الثالث النتائج التي تم الحصول عليها ومناقشتها.
أكسدة درجة حرارة منخفضة لأول أكسيد الكربون (II) في الهواء على أساس البلاديوم وكلوريدات النحاس يلعب اختيار الدعم دورًا مهمًا في إنشاء محفز نشط ومستقر. في هذا الصدد، تم اختبار إمكانية استخدام المواد التالية كحاملات: عينات أكسيد الألومنيوم التي تم الحصول عليها عن طريق تكليس -Al2O3 عند 1000، 1100 درجة مئوية (قريب في البنية من -Al2O3) وعند 1200 درجة مئوية (-Al2O3، اكسيد الالمونيوم)، نانو أكسيد الألومنيوم بحجم النانو، الذي تم الحصول عليه بطريقة البلازما الكيميائية، وأنابيب الكربون النانوية، وحوالي 10 عينات من التعديلات بحجم النانو لثاني أكسيد التيتانيوم، وتيتانات الباريوم. باستخدام الدعامات المشار إليها، تم تحضير المحفزات وفقًا للإجراء القياسي. تم اختبار النشاط التحفيزي لجميع المحفزات في ظل ظروف مماثلة (الحمل 12000 ساعة-1 (أو 24000 ساعة-1)، تركيز ثاني أكسيد الكربون في الغاز المصدر 100 مجم/م3 (أو 500 مجم/م3)، رطوبة الماء الساخن 9.30 جم/م3، درجة الحرارة DHW 25.0 درجة مئوية، وقت الاختبار 120 دقيقة). تمت مقارنة نشاط المحفزات الجديدة مع نشاط العينة القياسية PdCl2-CuCl2/-Al2O (1.5% بالوزن Pd، 3.5% بالوزن Cu). لقد ثبت أن المحفزات المحضرة على أساس المواد المذكورة أعلاه تكون أقل فعالية وثباتًا من العينة القياسية. وبالتالي، عند استخدام تعديلات ثاني أكسيد التيتانيوم كحامل، يتم عرض أعلى XOTN = (SAMPLE/XSTANDARD)100%) بواسطة المحفز المحضر على أساس العينة 4 بالبنية -TiO2 مع خليط من ثاني أكسيد التيتانيوم المائي. تم إظهار نشاط أقل إلى حد ما بواسطة المحفزات المستندة إلى عينات ذات بنية Anatase: عينات (XOTH = 30.5%) و6 (XOTH = 30.0%) مع خليط من -TiO2. تحتوي هذه العينات على أحجام بلورية مختلفة جدًا (L) (L = 40(2)، 150(7)، 165(8) للعينات 4، 5، 6، على التوالي) ومساحة سطح محددة (~ 15 م 2 / جم و ~ 170 م 2 / ز للعينات 4 (-TiO2) و6 (أناتاز)، على التوالي).
المحفزات المعتمدة على المحفزات "النقية" تكون غير نشطة عمليا
العينات 7 (L = 50 (2)، -TiO2) (XOTH = 6.0٪) و8 (L = 80 (4)، أناتاز) (XOTH = 1.0٪). لم نتمكن من تحديد أي علاقة واضحة بين النشاط التحفيزي للعينات المدروسة وخصائصها (أحجام البلورات ومساحة السطح المحددة)، ولكن العلاقة مع وجود أطوار الشوائب في العينة واضحة للعيان. اقترح عدد من المنشورات فرضية مفادها أن الطور السائل نشط في المحفز - وهو محلول من أملاح النحاس والبلاديوم في الماء، الموجود في مسام الناقل. ومع ذلك، فإن الحساسية العالية للخصائص التحفيزية لطبيعة الدعم (التي تتجلى في الأنشطة المختلفة والاستقرار) تناقض هذه الفرضية.
المحفز القياسي (PdCl2-CuCl2/-Al2O3) ليس مستقرًا بدرجة كافية في ظل ظروف الرطوبة العالية في إمدادات الماء الساخن. أحد اتجاهات تحسينه هو زيادة خصائصه الكارهة للماء. جرت محاولة لتثبيط المحفز القياسي PdCl2-CuCl2/-Al2O3 عن طريق تطبيق حمض دهني من مذيبات مختلفة على سطحه. تم ترسيب حمض دهني (5.5% من كتلة المحفز) من الإيثانول (العينة 9)، إيثر ثنائي إيثيل (العينة 10)، والهكسان (العينة 11). العينة 12 عبارة عن محفز قياسي (غير معدل) (الشكل 1). شروط الاختبار: استهلاك DHW 30 لتر/ساعة، VCATALYST = 1.3 مل (حمل 24000 ساعة-1)، DHW = 20.3 جم/م3، DHW = 23.0 0C، CCO، قبل المفاعل = 100 مجم/م3. نشاط العينات المعدلة أقل من نشاط العينة القياسية طوال التجربة بأكملها. وبالتالي، فإن تطبيق حمض دهني من مذيبات مختلفة على المحفز PdCl2-CuCl2/-Al2O3 النهائي يؤدي إلى انخفاض في النشاط.
أدى أيضًا CH3[-SiO(CH3)2-]nCH3) من ثلاثي كلورو الميثان إلى -Al2O3 (قبل التشريب بمحلول مائي من أملاح PdCl2 وCuCl2) وإلى المحفز القياسي النهائي أيضًا إلى انخفاض النشاط (الشكل 2). في العينات 13، 1.2، 2.4، 4.7، 9.5٪ من كتلة PMS-100، على التوالي، تم تطبيقها بشكل مبدئي على سطح -Al2O3. كمية أملاح النحاس والبلاديوم، بالكميات المقابلة، المترسبة على حامل قياسي (غير معدل -Al2O3). العينة 16 عبارة عن محفز قياسي، حيث يتم ترسيب 4.7% بالوزن من PMS-100 (بالوزن -Al2O3) على سطحه.
العينة 18 عبارة عن محفز قياسي (غير معدل). شروط الاختبار: استهلاك DHW 30 لتر/ساعة، VCATALYST= 1.3 مل (حمل 24000 ساعة-1)، DHW= 14.0 جم/م3، DHW= 23.0 0C، CCO، قبل المفاعل= 100 مجم/م3.
تجدر الإشارة إلى أن العينات 13، 14 أكثر استقرارا من العينة القياسية، على الرغم من أنها أقل نشاطا في بداية الاختبار.
تمت دراسة تأثير تعديل -Al2O3 مع أكاسيد النحاس (II)، الحديد (III)، المنغنيز (II)، الفضة (I)، وكذلك النحاس (0) (الشكل 3، 4). تم الحصول على أكاسيد المعادن الموجودة على سطح -Al2O3 عن طريق تحلل النترات المقابلة المترسب عن طريق التشريب البارد من محاليلها المائية. تم الحصول على النحاس (0) الموجود على سطح -Al2O3 عن طريق تقليل أكسيد النحاس (II) الموجود على سطح -Al2O3 في تيار من الهيدروجين عند درجة حرارة 2000 درجة مئوية. تم تحضير المحفزات وفق الطريقة القياسية، وتم حساب كمية أملاح النحاس والبلاديوم على أساس كتلة -Al2O3 غير المعدلة وتم تطبيق نفس الكمية من هذه الأملاح على جميع العينات. تحتوي العينات 19-21 (الشكل 3) على 3.5، 7.0، 14.0٪ بالوزن Fe على شكل Fe2O3، على التوالي. العينة 22 عبارة عن محفز قياسي (غير معدل). شروط الاختبار للعينات 19-22:
استهلاك الماء الساخن = 60 لتر/ساعة، VCATALYST= 1.3 مل (الحمل 48000 ساعة-1)، الماء الساخن= 19.7 جم/م3، الماء الساخن= 25.0 درجة مئوية، CCO، قبل المفاعل= 100 مجم/م3. العينات 23- (الشكل 4) تحتوي على 8% بالوزن. النحاس على شكل CuNO3، CuO، النحاس (0)، على التوالي. العينة 26 عبارة عن محفز قياسي (غير معدل). شروط الاختبار للعينات 23-26: استهلاك DHW 60 لتر/ساعة، VCATALYST = 1.3 مل (حمل 48000 ساعة-1)، DHW = 14.0 جم/م3، DHW = 20.0 0C، CCO، قبل المفاعل = 100 مجم/م3.
أرز. 1. اعتماد درجة الكربون (II) على وقت التجربة (t) الكربون (II) على وقت التجربة (t) على محفزات الستيرين المعدلة (العينات 13 ()، مع المحفزات الحمضية (العينات 9 ()، 10 ( )، 11 ()، 12 ()).
أرز. 3. اعتماد درجة الكربون (II) على وقت الخبرة (t) الكربون (II) على وقت الخبرة (t) المحفزات (عينات 19 ()، تعديل -Al2O3 مع أكسيد الحديد (III)، النحاس (II) ) أكسيد، والنحاس (0 ) يزيد من نشاط واستقرار المحفز.
التعديل باستخدام نترات النحاس (II) له تأثير سلبي.
دراسة تكوين الطور وبنية العينات 1- بواسطة قياس حيود الأشعة السينية المسحوقة باستخدام إشعاع السنكروترون تمت ملاحظة عدد من الخصائص القصوى الموسعة للعينات ذات الحجم النانوي في نمط حيود -Al2O3 (الشكل 5). في أنماط الحيود للعينتين 2 و3، إلى جانب قمم الطور -Al2O، توجد انعكاسات مكثفة ضيقة، تتوافق بيانات الأشعة السينية الخاصة بها مع الطور Cu2Cl(OH)3 مع بنية باراتاكاميت، وما إلى ذلك.
غرام. R-3m (الشكل 5). لا توجد فروق ذات دلالة إحصائية بين أنماط حيود العينات 2 و 3.
دراسة البنية المجهرية للعينات باستخدام المجهر الإلكتروني الماسح (SEM) كشفت طريقة SEM عن تراكمات جزيرة من البلورات الدقيقة (مركبات النحاس على ما يبدو) في العينة 2 (الشكل 7)، وربما مركبات النحاس والبلاديوم في العينة 3 (الشكل 8). على السطح -Al2O3.
نتائج دراسة البنية المجهرية للعينات 1-3 باستخدام طريقة SEM (الشكل 6-8) لا تتعارض مع بيانات قياس حيود المسحوق (الشكل 5):
البلورات النانوية من الطور البلوري Cu2Cl(OH)3 مع بنية باراتاكاميت موجودة فقط في العينات 2 و3، وعدد البلورات النانوية ذات الأوجه أكبر بكثير في العينة 3.
وجوه البلورة النانوية في العينة 3 (الشكل 8) لها شكل المعين، وهو نموذجي للشكل البسيط للمعين، وهذا يؤكد أيضًا تبلور التعديل الثلاثي Cu2Cl(OH)3 على سطح -Al2O3؛ . من الممكن أن يؤدي الوجود المشترك لـ Cu2Cl(OH)3 وPdCl2 في العينة 3 إلى تعزيز عملية التبلور وزيادة حجم الجسيمات.
أرز. 7. صورة SEM 25000).
مجال التنسيق للبلاديوم والنحاس في الأملاح الأولية، ومحاليل التشريب وعلى سطح الدعم باستخدام طريقة XANES، وأطياف XANES من PdCl2 (الصلب)، ومحلول مائي من PdCl2 وCuCl2، وعينة عند الحافة K. البلاديوم متقاربة في الشكل والموضع من الحد الأقصى للامتصاص الرئيسي (الشكل 9). ويشير هذا إلى أن الحالة الإلكترونية للبلاديوم في هذه العينات لا تختلف بشكل كبير. يتوافق الحد الأقصى للامتصاص في الأطياف مع الانتقال الإلكتروني 1s5p. على ما يبدو، أثناء تحضير المحفز، يتم الحفاظ على حالة أكسدة البلاديوم (II) وبيئة التنسيق المربعة لذرات الكلور.
أطياف XANES عند الحافة K من النحاس لـ CuCl2*2H2O(s)، والمحاليل المائية لـ CuCl2 وCuCl2 وPdCl2، العينات 2 و3 لها اختلافات كبيرة (الشكل 10). يتوافق الحد الأقصى للامتصاص عند 8995 فولت مع الانتقال الإلكتروني 1s4p. تعكس القمم والكتفين الثانوية انتقالات الإلكترون إلى المدارات غير المأهولة وفقًا لقواعد اختيار ثنائي القطب. يشير الرنين المسبق الضعيف جدًا عند E ~ 8976 eV إلى الانتقال الإلكتروني 1s3d المحظور رسميًا ثنائي القطب، والذي يتجلى بسبب التهجين الجزئي p-d والمساهمة الرباعية. إنه بمثابة مؤشر طيفي موثوق لوجود مركبات النحاس (II). لا يمكن تمييز أطياف المحاليل المائية والعينتين المطبقتين 2 و3 في أزواج ضمن الخطأ التجريبي. يشير الشكل غير المتماثل للحد الأقصى الطيفي مع كتف منخفض الطاقة بشكل واضح في حالة المحفزات المدعومة والمرجع (CuCl2*2H2O(s)) إلى بيئة مختلطة من الأكسجين والكلور لذرات النحاس. في حالة المحاليل المائية لـ CuCl2، التي يحدث فيها التحلل المائي واستواء CuCl2، تتغير بيئة الأكسجين والكلور المختلطة إلى أكسجين كامل، ويكون شكل الأطياف قريبًا من الشكل المتوقع للتنسيق الهرمي الرباعي لذرات النحاس بواسطة ذرات الأكسجين .
يمكن الحصول على معلومات أكثر تفصيلاً لا لبس فيها حول معلمات البيئة المحلية لذرات النحاس والبلاديوم في العينات 2 و3 وحلول السلائف من التحليل الكمي لأطياف EXAFS.
دراسة البيئة المحلية للبلاديوم والنحاس في الأملاح الأولية ومحاليل التشريب وعلى سطح الدعامة باستخدام طريقة EXAFS في عينة PdCl2 (الصلبة) وفقاً لبيانات EXAFS (الشكل 11، الجدول 1 (منحنيات التوزيع الشعاعي). من الذرات (RDA) التي تم الحصول عليها عن طريق تحويل فورييه لأطياف EXAFS على نحو حافة Pd)))، تتوافق البيئة المحلية للبلاديوم مع بيئة البلاديوم في التركيب البلوري لتعديل PdCl2 (الصلب)، والذي يتضمن ككتل هيكلية Pd6Cl12 سداسيات ذات ثماني وجوه من ذرات البلاديوم عند القمم، متصلة بواسطة جسور من كلوريدين دون تكوين روابط Pd-Pd.
تقوم كل ذرة البلاديوم بتنسيق أربع ذرات كلور لتكوين متعدد السطوح ذو تنسيق مربع. في المحلول المائي لـ PdCl2 وCuCl2، من المحتمل وجود شظايا مربعة مسطحة معزولة 2- (الجدول 1). لم يتم اكتشاف أي تفاعل محدد مع Pd...Cu.
في المحفز (العينة 3)، يتم الحفاظ على البيئة المربعة المستوية للبلاديوم مع ذرات الكلور، ولكن هناك تشويه طفيف: وفقًا لنتائج تحسين بيانات EXAFS، لوحظ التوافق الأمثل بين التجربة والنظرية للنموذج من البيئة المحلية للبلاديوم مع ذرات الكلور مع رابطة Pd-Cl واحدة أطول قليلاً من الأخرى (الجدول 1). في منحنى PRA للمحفز، تظهر قمم المسافات الطويلة في نطاق 3-4، ولكن لا يتم وصفها كمساهمات من Pd...Pd أو Pd...Cu، ولكنها تتوافق مع الذرات الأخف - على سبيل المثال، Pd...Al، والتي قد تشير إلى تكوين روابط سد Pd-Cl-Al مع مواقع التبادل الأيوني للحامل أثناء الامتصاص الكيميائي.
طيف EXAFS عند حافة K من النحاس لـ CuCl2*2H2O(sol) (الشكل 12، الجدول (تظهر منحنيات التوزيع الشعاعي للذرات (RDA) التي تم الحصول عليها بواسطة تحويل فورييه لأطياف EXAFS عند حافة K من النحاس)) يتوافق تماما مع البيانات الهيكلية الأدب. محيط النحاس عبارة عن مربع مسطح مكون من ذرتين كلور وذرتين أكسجين من الماء. تم بناء الهيكل من هذه المربعات المعزولة.
هناك تفاعلان ثانويان إضافيان Cu...Cl، يكملان تنسيق متعدد السطوح لذرات النحاس إلى هرم ثنائي رباعي الأضلاع ويشكلان أكوامًا لا حصر لها من مربعات CuCl2O2.
في محاليل CuCl2 (بدون ومع البلاديوم)، تتغير بيئة ذرات النحاس إلى أكسجين خالص، وفي نفس الوقت، إلى هرمي رباعي رباعي الزوايا، وذلك بسبب تأثير Jahn-Teller، وهو أمر نموذجي لمركبات النحاس (II) (الشكل 12). ، الجدول 2). من وجهة نظر البيئة المحلية للنحاس، لا توجد فروق ذات دلالة إحصائية بين الحلول.
أرز. 11. منحنيات PRA على الحافة K لـ Pd. أرز. 12. منحنيات PRA على الحافة K للنحاس.
في العينات 2 و 3، تم العثور على نوعين غير متكافئين من ذرات النحاس. في البيئة التنسيقية للنحاس يوجد الأكسجين؛ ولا يوجد سوى الكلور في الغلاف الخارجي (وفقط في أحد نوعي ذرات النحاس).
طاولة 1. معلمات البيئة المحلية بناءً على نتائج معالجة أطياف EXAFS عند حافة K لـ Pd: CS - مجالات التنسيق، N - رقم التنسيق، R - المسافة بين الذرات، 2، 2 - معلمة Debye-Waller، Rf - عامل عدم اليقين. وترد المسافات بين الذرية من البيانات البلورية بين قوسين.
طاولة 2. معلمات البيئة المحلية بناءً على نتائج معالجة أطياف EXAFS عند حافة Cu K: CS - مجالات التنسيق، N - رقم التنسيق، R - المسافة بين الذرية، 2، 2 - معلمة Debye-Waller، Rf - عامل عدم اليقين. وترد المسافات بين الذرية من البيانات البلورية بين قوسين.
PdCl2-CuCl2/-Al2O3) Cu...Cl 1 2.89 (2.79) 0، نتائج دراسة الحالة الإلكترونية للنحاس والبلاديوم عن طريق التحليل الطيفي IR-Fourier المنتشر باستخدام جزيئات المسبار في أطياف الانعكاس المنتشر للأشعة تحت الحمراء للعينات 1 (Al2O3) ) و (CuCl2/Al2O3)، المسجلة في وجود أول أكسيد الكربون في درجة حرارة الغرفة، لا توجد نطاقات مميزة لاهتزاز تمدد رابطة CO في جزيء أول أكسيد الكربون (II). وفي الوقت نفسه، يحتوي طيف العينة 3 (CuCl2-PdCl2/Al2O3) على ثلاثة نطاقات في 1928 و1990 و2114 سم-1 (الشكل 13).
ثاني أكسيد الكربون الممتز على Pd(II) غير المشبع بشكل تنسيقي أو Pd(I) و/أو Cu(I). يصف النطاق عند 1990 سم-1 امتصاص ثاني أكسيد الكربون في الشكل الخطي على Pd(0) (ربما يكون نتيجة لاختزال البلاديوم مع أول أكسيد الكربون (II))، بينما يميز النطاق عند 1928 سم-1 امتزاز ثاني أكسيد الكربون في شكل تجسير، على الأرجح في Pd(I).
اتصال العينة 3 بأول أكسيد الكربون (II) عند PCO = 30 ملم زئبق. فن.
يسمح لنا بالحصول على الطيف الموصوف أعلاه (الشكل 13). خلال 50 دقيقة لا يوجد أي تغيير في شدة نطاقات الطيف. بعد 50 دقيقة، تم إطلاق الهواء في الأمبولة. أدى الاتصال بالهواء إلى تغيير في أطياف الأشعة تحت الحمراء المسجلة (الشكل 14).
أرز. 13. طيف الأشعة تحت الحمراء للعينة 3 الشكل. 14. أطياف الأشعة تحت الحمراء للعينة 3.
بالفعل في أول 50 طيفًا تم تسجيلها بعد دقائق، لوحظ وجود نطاق عند 2346 سم-1، وهو ما يميز ثاني أكسيد الكربون الممتز فيزيائيًا. تزداد شدة هذا النطاق لمدة تصل إلى 7 دقائق ولا تتغير بعد ما يصل إلى 32 دقيقة، بينما تختفي النطاقات المرتبطة بمجموعات ثاني أكسيد الكربون تدريجيًا. تشير هذه البيانات إلى أن الأكسجين يجب أن يشارك بشكل مباشر في تكوين ثاني أكسيد الكربون من ثاني أكسيد الكربون.
الدراسة الموقعية للمحفز باستخدام طرق XAFS باستخدام التحليل الطيفي لامتصاص الأشعة السينية، تمت دراسة سلوك المحفز في الموقع في وجود أول أكسيد الكربون (II) فقط في النيتروجين (بدون ماء وبدون أكسجين) في التجربة الأولى. في ظل هذه الظروف، لم يتم اكتشاف أي تغييرات مهمة في الأطياف عند حافة Pd K أو حافة Cu K لمدة 12 ساعة على الأقل. أي أنه بدون ماء وبدون أكسجين، لا يحدث تفاعل أكسدة أول أكسيد الكربون (II). وفي التجربة الثانية تمت دراسة سلوك المحفز في وجود الماء وأول أكسيد الكربون في جو نيتروجيني خالي من الأكسجين. عند حافة K لـ Pd، لوحظت تغيرات بطيئة وعميقة جدًا - ظهور رابطة Pd-Pd، والتي، إلى جانب بيانات XANES، تشير إلى انخفاض متزايد تدريجي في البلاديوم (الشكل 15 (يُظهر منحنيات التوزيع الشعاعي لـ Pd) الذرات (RDA) التي تم الحصول عليها عن طريق تحويل فورييه لأطياف EXAFS عند K-edge Pd)). عند الحافة K للنحاس، تم الكشف عن التخفيض الجزئي للنحاس (II) إلى النحاس (I) دون اضطراب كبير في الهيكل، مع الحفاظ على مرحلة الباراتاكاميت (الشكل 16).
الشكل 15. منحنيات PPA على حافة K لـ Pd. الشكل 16. أطياف XANES عند حافة Cu K.
بدون الأكسجين، يحدث تفاعل متكافئ لأكسدة أكسيد الكربون (II) مع اختزال البلاديوم (II) والنحاس (II) مع ظهور رابطة Pd-Pd.
آلية تكوين الموقع النشط للحفز الكيميائي عند إثبات الفرضية حول آلية تكوين الموقع النشط للحفز الكيميائي، تم استخدام الفرضيات التالية، بناءً على بيانات من الطرق الفيزيائية ونتائج التجارب الخاصة.
1) النحاس (II) على شكل CuCl(OH)3 مع بنية باراتاكاميت على سطح -Al2O3 بدون البلاديوم لا يؤكسد ثاني أكسيد الكربون إلى ثاني أكسيد الكربون. الأساس هو التجارب التي تم إجراؤها خصيصًا على النشاط التحفيزي لعينة CuCl2/-Al2O3 وغياب نطاقات الامتصاص في أطياف DRIFT لعينة CuCl2/-Al2O3 في جو ثاني أكسيد الكربون.
2) يحفز البلاديوم أكسدة ثاني أكسيد الكربون بواسطة النحاس، لأنه وفقًا لأطياف XAFS في الموقع لعينة CuCl2-PdCl2/-Al2O3 في جو N2+CO+H2O بدون الأكسجين، يظهر النحاس (I) (الشكل 16). تعتبر بيانات DRIFT من نفس العينة غامضة، ولكنها لا تتعارض مع بيانات XAFS في الموقع (الشكلان 13 و14).
3) البلاديوم (II) يؤكسد ثاني أكسيد الكربون بشكل متكافئ بدون CuCl2. تم إجراء الاختبارات على عينات من PdCl2-MeCl2/-Al2O3 (حيث Me – Mn, Ni)، وأيضًا عينات من PdCl2-MeCl (حيث Me – Li، Na، K، H)، تؤكد هذه الحقيقة.
لذلك، لا يتأكسد البلاديوم (0 و/أو I) بواسطة الأكسجين في غياب النحاس (I و/أو II).
4) يؤدي إدخال O2 (وربما الرطوبة الإضافية) إلى تعزيز تكوين ثاني أكسيد الكربون من ثاني أكسيد الكربون الممتز وفقًا لبيانات DRIFT (الشكل 14).
كمية معينة من الرطوبة (وجود شريط امتصاص، مما يؤدي إلى تدريب عينة محفز على سطح -Al2O3.
5) في جو N2 + CO بدون H2O وO2، وفقًا لبيانات XAFS في الموقع، لم تتم ملاحظة أي تغييرات في الأطياف عند حافة Cu K وعند حافة Pd K خلال 12 ساعة. أدت إضافة بخار الماء إلى تقليل Pd(II) وظهور مجمعات Pd(I) ذات رابطة Pd-Pd (الشكل 15). ولذلك، فإن امتصاص الماء يعزز تخفيض Pd(II).
6) يمكن تنسيق أول أكسيد الكربون على سطح المحفز في شكل تجسير. ويتجلى ذلك من خلال نطاق الامتصاص عند 1928 سم -1 في طيف DRIFT (الشكل 13)، وبشكل غير مباشر، من خلال وجود رابطة Pd-Pd وفقًا لبيانات XAFS في الموقع (الشكل 15).
وهكذا يمكن تمثيل عملية تكوين المركز النشط لتحفيز أكسدة ثاني أكسيد الكربون بالأكسجين بالمراحل التالية:
- تخفيض Pd(II) في وجود H2O وCO؛
الانتشار السطحي لمجمع Pd(0) المخفض مع تكوين Pd2(I) وفقًا للتفاعل (1)، يتم تثبيت مجمع Pd2(I) عن طريق سد مجموعات الكربونيل - Pd2(-CO)2؛
- يحفز مركب Pd2(-CO)2، المتفاعل مع H2O وCu(II)، الاختزال الجزئي لـ Cu(II) إلى Cu(I) وفقًا للتفاعل (2) - فيونتيجة لهذه التحولات، يظهر مركز تحفيز نشط: Pd2(I)–Cu(I)n (على غرار المركب (PdCl2)2CuCl2(4DMF) في عملية أكسدة الفاكوير في نظام DMF-H2O)، - أو مركزين على سطح Pd2(I) وCu(I)n، غير متصلين بواسطة جسور كيميائية - حاملات الإلكترون.
نتائج دراسة الأنماط الحركية: قبل إجراء القياسات الحركية، تم إجراء تجارب لاختيار تركيب وحجم حبيبات المحفز وظروفها للتأكد من حدوث التفاعل في المنطقة الحركية. ولهذا الغرض، تم الحصول على اعتماد معدل تكوين ثاني أكسيد الكربون على حجم حبيبات المحفز وعلى معدل التدفق الخطي لإمدادات الماء الساخن. ونتيجة لذلك، تم اختيار الشروط التالية: حجم جزء المحفز 0.5-1 مم وسرعة التدفق الخطي لا تقل عن 3 سم / ثانية. لا تضمن هذه الظروف حدوث التفاعل في المنطقة الحركية فحسب، بل تضمن أيضًا أن تكون درجة تحويل أول أكسيد الكربون (II) أقل من 10% على مدى نطاق واسع من التغيرات في الضغوط الجزئية لـ H2O وO2. تم تحميل 1 مل من المحفز CuCl2-PdCl2/-Al2O3 (1.5% بالوزن Pd، 17.5% بالوزن Cu) في المفاعل، وكان ارتفاع الطبقة 10 مم. في ظل هذه الظروف، أجريت جميع التجارب الحركية عند نفس الضغط الجزئي لأول أكسيد الكربون (II) (45 مم زئبق) وضغط إجمالي قدره 744 مم. زئبق فن..
باستخدام طريقة تجربة العامل الواحد، تم الحصول على اعتمادين جزئيين أساسيين لمعدل تكوين ثاني أكسيد الكربون على الضغوط الجزئية للماء والأكسجين لاختبار الفرضيات حول آلية التفاعل (الشكل 17، 18). أظهرت معالجة التبعيات التي تم الحصول عليها أن الترتيب الرسمي في PH2 O قريب من 1.7، وفي PO2 ~ 0.8. لم يتم تحديد ترتيب أول أكسيد الكربون وكان من المفترض أن يكون قريبًا من الصفر بناءً على البيانات التي تم الحصول عليها مسبقًا في نظام مماثل (حركية وآلية أكسدة أول أكسيد الكربون على محفز معقد معدني مدعوم PdCl2-CuCl2/-Al2O3 / I.A.
كوتاريفا [وآخرون] // الحركية والحفز - 2008. - ت. 49، رقم 5. - ص 22-30).
وتم طرح الفرضيات حول الآلية في إطار الآليات “المدمجة” و”المنفصلة”. في إطار آلية "الانصهار"، درسنا متغيرًا يشتمل على مركز واحد، بما في ذلك Pd(I) وCu(I)، ومركزين: البلاديوم (I) ينسق أول أكسيد الكربون (II) والماء والنحاس (I). ينسق الأكسجين. وفي الحالة الأخيرة، يؤدي تفاعل هذه المراكز إلى تكوين ثاني أكسيد الكربون. تشتمل متغيرات آلية "الانقسام" على تكوين ثاني أكسيد الكربون من أول أكسيد الكربون والماء في مركز البلاديوم (I) لتكوين البلاديوم (I) (أو البلاديوم (0)) هيدريد، يليه إعادة أكسدة الشكل المخفض للعنصر النشط. موقع يتضمن مركب الأكسجين والنحاس (I).
عند استخلاص المعادلات الحركية، استخدمنا افتراض تجانس السطح وثبات حالة البلاديوم والنحاس عند اختلاف الظروف التجريبية.
النموذج المشتق على أساس الآلية "المدمجة" (I) له الشكل (1):
[ Z(CO)(COOH)] H3O+ + O2 [(O2)Z(CO)(COOH)] H3O+ [(O2)Z(CO)(COOH)] H3O+ [ Z(CO)(OOH)] H3O+ + CO الآلية (I) تتوافق مع المعادلة (1).
يأخذ توازن الطلاء في الاعتبار الوسطيات السطحية Z(CO)2 (O2) و [Z(CO)(COOH)] H3O+.
Z - مركب Pd(I) وCu(I)، يتكون في المرحلة الأولية.
يمكن تمثيل نسخة أخرى من الآلية "المدمجة" (II) بالرسم البياني التالي:
X2Pd(I)(CO)2 (H2O) + H2O [ X2Pd(I)(CO)(COOH)] H3O+ [ X2Pd(I)(CO)(COOH)] H3O+ + X2Cu(I)2 (O2) [ X2Pd (I)(CO)(OOH)] H3O+ + CO2 + X2Cu(I) [ X2Pd(I)(CO)(OOH)] H3O+ + CO X2Pd(CO)2 + H2O2 + H2O تتوافق هذه الآلية مع المعادلة (2) .
K 4K1K 2K 3، = K1K 2، = K 3 - الثوابت الفعالة.
يتم تجميع موازين طلاء السطح بشكل منفصل للنحاس (تؤخذ الوسائط الوسيطة X2Cu(I)2، X2Cu(I)2 (O2) في الاعتبار) والبلاديوم (الوسيطات X2Pd(I)(CO)2، [ X2Pd(I)(CO) (COOH) تؤخذ بعين الاعتبار)] H3O+).
لا يمكن تمييز النموذجين 1 و2، اللذين يصفان البيانات التجريبية بشكل مناسب، حركيًا (الشكل 17، 18، الخطوط الصلبة). تجدر الإشارة إلى أن كلا النموذجين يعطيان اعتماداً على شكل حرف S للمياه.
أبسط نسخة من الآلية "المنفصلة" لها الشكل (III):
X2Pd2 (CO)2 (H2O) + H2O [ X2Pd2 (CO)(COOH)] H3O+ [ X2Pd2 (CO)(COOH)] H3O+ [ X2Pd2H(CO)] H3O+ + CO [ X2Pd2H(CO)] H3O+ + X2Cu2 (O2) ) آلية X2Pd2 (CO) + X2Cu2 + H2O2 + H2O (III) تتوافق مع المعادلة (3).
الثوابت.
تم تجميع موازين الطلاء السطحي، كما في حالة اشتقاق المعادلة (2)، بشكل منفصل للنحاس (تم أخذ الوسيطين X2Cu2 وX2Cu2O2 في الاعتبار) والبلاديوم (X2Pd2 (CO)2، [X2Pd2H(CO)] H3O+).
تم الحصول على أفضل النتائج بالنسبة لمتغيرات الآلية "المدمجة" (الشكل 17، 18، الخطوط الصلبة توضح وصف البيانات التجريبية بواسطة النموذجين 1 و2). الوصف في حالة آلية منفصلة أسوأ بكثير (الشكل 17، 18، الخطوط المنقطة توضح وصف البيانات التجريبية حسب النموذج 3).
أرز. 17. وصف التجربة - الشكل 17. 18. وصف البيانات التجريبية () RCO2 = بيانات f(PH2O) () نماذج RCO2 = f(PO2) 1 (الخط الصلب) و3 نماذج 1 (الخط الصلب) وفي الآليات من الأول إلى الثالث، يكون دور الماء هو ذلك أحد جزيئاته، الذي يهاجم أكسيد الكربون (II) المنسق، يشكل مجموعة هيدروكسي كربونيل، في حين أن جزيء الماء الثاني، الذي يعمل كقاعدة، يقبل البروتون. يعزز الأكسجين تحلل مجموعة الهيدروكسي كربونيل.
وبالتالي، استنادًا إلى جميع البيانات التي تم الحصول عليها، فإن آليات التفاعل الأكثر احتمالاً هي أكسدة أول أكسيد الكربون (II) عند درجة حرارة منخفضة على المحفز PdCl2-CuCl2/-Al2O3، حيث يتكون ثاني أكسيد الكربون بمشاركة مباشرة من الماء والأكسجين. في مركز واحد يشمل البلاديوم (I) والنحاس (I) أو نتيجة لتفاعل مركب البلاديوم (I) السطحي، الذي ينسق أول أكسيد الكربون (II) والماء، ومركب النحاس السطحي (I)، الذي ينشط الأكسجين.
الاستنتاجات
1. لا تتغير بيئة التنسيق للبلاديوم (مربع مسطح من ذرات الكلور) أثناء تحضير المحفز أثناء الانتقال من كلوريد البلاديوم (II) الصلب (-تعديل) إلى محلول مائي يحتوي على كلوريد البلاديوم (II) والنحاس (II) الكلوريد، وعند تطبيق كلوريد البلاديوم والنحاس من محلول مائي على سطح -Al2O3، باستثناء استطالة إحدى روابط البلاديوم-كلور الأربعة.2. تتغير البيئة المحلية للنحاس أثناء تحضير المحفز من المختلطهرمي رباعي الأكسجين - كلور في CuCl2*2H2O من خلال هرمي رباعي الأكسجين في محلول مائي من كلوريد النحاس (II) إلى بيئة أكسجين منتظمة بشكل غير كامل مع تفاعل ثانوي Cu...Cl في بنية Cu2Cl(OH)3 (باراتاكاميت) تشكلت على السطح - Al2O3.
3. تنشأ ظروف فريدة على سطح أكسيد الألومنيوم لتكوين Cu2Cl(OH)3. يمكن أن تساهم المراكز الرئيسية لسطح -Al2O في تحلل مائي أكثر اكتمالاً لـ CuCl2 في محاليل التشريب.
4. في وجود بخار الماء وأول أكسيد الكربون، يتم تقليل النحاس والبلاديوم ويتم تنسيق أول أكسيد الكربون (II) على سطح المحفز لتكوين مجموعات كربونيل طرفية وسد. مركبات كربونيل البلاديوم هي المركبات الوسيطة الأكثر احتمالاً.
5. يحدث تحويل أول أكسيد الكربون (II)، بالتنسيق مع البلاديوم، إلى ثاني أكسيد الكربون بمشاركة الأكسجين والماء.
6. لا يوجد على سطح المحفز المحضر حديثًا مركز نشط واحد مسؤول عن أكسدة أول أكسيد الكربون بالأكسجين.
7. بناءً على تمييز فرضيات الآلية باستخدام النتائج التي تم الحصول عليها باستخدام الطرق الفيزيائية والبيانات الحركية، يتم اقتراح الآلية الأكثر ترجيحًا لتكوين ثاني أكسيد الكربون والتي تشمل المركز (المراكز) بما في ذلك Pd(I)، Cu(I) وأول أكسيد الكربون المنسق الجزيئات (II) والماء والأكسجين.
المحتوى الرئيسي للأطروحة موضح في
في المنشورات التالية
1. آلية أكسدة أول أكسيد الكربون في درجات الحرارة المنخفضة في الهواء على المحفز PdCl2-CuCl2/-Al2O3 / D. N. Titov [وآخرون] // المؤتمر الروسي الثالث "المشاكل الحالية للبتروكيماويات" بمشاركة دولية، مخصص للدورة الخامسة والسبعين الذكرى السنوية للأكاديمي ن. أ. بلايت: مجردة. تقرير، زفينيجورود، روسيا، 27-30 أكتوبر 2009.– زفينيجورود، – 2009. – الجزء 2. – ص 141 – 142.
2. حالة المحفز PdCl2-CuCl2/-Al2O3 لأكسدة أول أكسيد الكربون في درجات الحرارة المنخفضة في الهواء وفقًا للطرق الفيزيائية / D. N. Titov [وآخرون] // المدرسة العلمية لعموم روسيا للشباب "المشاكل الحالية للكيمياء الفيزيائية الحديثة" ": خلاصة. تقرير، موسكو، روسيا، أكتوبر-نوفمبر 2009. – موسكو، – 2009. – ص 120.
3. دراسة عامل مساعد لأكسدة أول أكسيد الكربون في الهواء بدرجة حرارة منخفضة باستخدام الطرق الفيزيائية والكيميائية / د.ن.
تيتوف [إلخ.] // المؤتمر العلمي والتقني الثالث للشباب "التقنيات الكيميائية عالية التقنية - 2009": الملخص. تقرير، موسكو، روسيا، 13-14 نوفمبر 2009. – موسكو، – 2009. – ص 87.
4. تطوير طريقة للحصول على تعديلات نانوية لثاني أكسيد التيتانيوم وتوصيفها وخصائصها / P. A. Demina [وآخرون] // المؤتمر العلمي والتقني الثالث للشباب "التقنيات الكيميائية عالية التقنية - 2009": ملخص. تقرير، موسكو، روسيا، 13-14 نوفمبر 2009. – موسكو، – 2009. – ص 61.
5. حالة المحفز PdCl2-CuCl2/-Al2O3 لأكسدة أول أكسيد الكربون (II) في درجات الحرارة المنخفضة في الهواء / D. N. Titov [وآخرون.] // المؤتمر العلمي والتقني للشباب "المشكلات الحديثة للحفز الكيميائي وتكرير النفط" المخصص إلى الذكرى المئوية لـ N. S. Pechuro: ملخص. تقرير، موسكو، روسيا، 20-21 أكتوبر 2010. - موسكو، - 2010. - ص 55-56.
6. التعديلات النانوية لثاني أكسيد التيتانيوم مع هياكل Anatase و-TiO2: التركيب، البنية المجهرية، الخصائص / G. M. Kuzmicheva [وآخرون] // مقال تلقاه محررو مجلة "المواد غير العضوية".
7. حالة البلاديوم والنحاس في المحفز الطازج PdCl2-CuCl2/-Al2O3 لأكسدة أول أكسيد الكربون في درجات الحرارة المنخفضة / D. N. Titov [وآخرون] // نشرة MITHT - 2010. - T. V، رقم 3 - ص 62 - 68.
أعمال مماثلة:
"تقييم جافريلوفسكايا ماريا ألكساندروفنا لكفاءة استصلاح الأراضي المضطربة (نهج النظام البيئي) التخصص: 08.00.05 - اقتصاديات وإدارة الاقتصاد الوطني (اقتصاديات الإدارة البيئية) ملخص الأطروحة لدرجة مرشح العلوم الاقتصادية إيكاترينبرج 2007 PDF تم إنشاء النسخة الاحترافية من FinePrint pdfFactory Pro-PrufFactory. www.context-g 2 تم تنفيذ العمل في قسم الاقتصاد البيئي في المؤسسة التعليمية الحكومية للتعليم العالي في ولاية الأورال..."
"زايتسيفا يوليا نيكولاييفنا الجوانب الفيزيائية والكيميائية للتحكم بالكهرباء في إنتاج الألومنيوم التخصص 02.00.04 - الكيمياء الفيزيائية ملخص الأطروحة لدرجة مرشح العلوم الكيميائية كراسنويارسك - 2010 تم تنفيذ العمل في معهد الأكاديمية الروسية للعلوم العلوم، معهد الكيمياء والتكنولوجيا الكيميائية التابع للقسم السيبيري التابع لأكاديمية العلوم الروسية المشرف العلمي: دكتور في العلوم الكيميائية، البروفيسور كيريك سيرغي دميترييفيتش الخصوم الرسميون: دكتور في الكيمياء..."
"KOZAEVA LEILA PETROVNA هندسة أساسيات الوحدات المعجمية في أعمال فريدريش دورينمات (الجانب المعرفي العملي) التخصص 10.02.04 - اللغات الألمانية ملخص الأطروحة لدرجة مرشح العلوم اللغوية موسكو - 2008 تم إنجاز العمل في قسم اللغويات الألمانية كلية فقه اللغة، المؤسسة التعليمية الحكومية للتعليم المهني العالي، موسكو جامعة الدولةسميت باسم إم.في. لومونوسوف المشرف العلمي: دكتوراه في فقه اللغة، أستاذ..."
"Matveeva Elena فلاديميروفنا تطوير تكنولوجيا التعويم الكهربائي لمعالجة مياه الصرف الصحي من مؤسسات النقل من المنتجات البترولية 05.17.03 - تكنولوجيا العمليات الكهروكيميائية والحماية من التآكل ملخص أطروحة للحصول على الدرجة العلمية لمرشح العلوم التقنية موسكو - 2006 2 تم تنفيذ العمل في قسم تكنولوجيا الإنتاج الكهروكيميائي بالجامعة الروسية للتكنولوجيا الكيميائية. دي مندليف. مرشح المشرف العلمي للكيمياء..."
"Korneev Igor Sergeevich معالجة نفايات مواد البوليمر والمنتجات المطاطية إلى مكونات وقود المحركات التخصص 05.17.04 - تكنولوجيا المواد العضوية الملخص أطروحات لدرجة المرشح للعلوم الكيميائية موسكو-2011 www.sp-department.ru العمل المنجز باللغة الروسية أم الجامعة التكنولوجية الكيميائية لهم. دي. مندليف مرشح العلوم التقنية، أستاذ مشارك المشرف العلمي: سوشكوف يوري بافلوفيتش روسي..."
"Lebedeva Anna Vitalievna Vitiary art of Obskiy Ugrov Specialty 17.00.04-الفنون الجميلة والفنون الزخرفية والتطبيقية والهندسة المعمارية مؤلفة أطروحة لدرجة مرشح تاريخ الفن بارناول-2011 تم الانتهاء من العمل في قسم تاريخ الفن الروسي والأجنبي المدير العلمي لجامعة ولاية FSBEI: دكتوراه في تاريخ الفن، البروفيسور ستيبانسكايا تمارا ميخائيلوفنا الرسمية..."
"جريشين مكسيم فياتشيسلافوفيتش المجهر النفقي الماسح والتحليل الطيفي لأكسيدات النانو المعدنية 01/04/17 - الفيزياء الكيميائية، الاحتراق والانفجار، فيزياء الحالات القصوى للمادة ملخص أطروحة درجة الدكتوراه في العلوم الفيزيائية والرياضية موسكو - 2010 العمل تم تنفيذه في معهد الأكاديمية الروسية للعلوم، معهد الفيزياء الكيميائية الذي يحمل اسم N.N Semenov RAS، المعارضون الرسميون: دكتور في العلوم الفيزيائية والرياضية، Ryabenko Alexander Georgievich،..."
"بروكوبييفا ألينا كيريلوفنا جمل معقدة في نصوص ياكوت التخصص 10.02.02 - لغات شعوب الاتحاد الروسي (لغة ياكوت) ملخص الأطروحة لدرجة مرشح العلوم اللغوية ياكوتسك 2013 تم الانتهاء من العمل في قسم لغة الياقوت بمعهد لغات وثقافات الشمال الشرقي الاتحاد الروسيالمؤسسة التعليمية الحكومية الفيدرالية المستقلة للتعليم العالي المهني..."
"Ustyugov Sergey Dmitrievich النمذجة العددية للاضطرابات القابلة للضغط في مشكلة تكوين وتطور النجوم 05.13.18 - النمذجة الرياضية والأساليب العددية وحزم البرامج مجردة أطروحات لدرجة الدكتوراه في العلوم الفيزيائية والرياضية موسكو - 2012 1 العمل المنجز في معهد الرياضيات التطبيقية الذي يحمل اسم M.V.Keldysh RAS المعارضون الرسميون: عضو مناظر. راس، بتروف آي بي. طبيب..."
"مقاومة مششيرياكوفا إيكاترينا نيكولاييفنا لديدان الأرض (OLIGOCHAETA، LUMBRICIDAE، MONILIGASTRIDAE) لدرجات الحرارة السلبية 02/03/08 - ملخص علم البيئة من الأطروحة للحصول على درجة مرشح العلوم البيولوجية سانت بطرسبرغ 2011 تم إنجاز العمل في مختبر مؤسسات علم الأحياء الحيوية في روسيا أكاديمية العلوم معهد المشاكل البيولوجية فرع شمال الشرق الأقصى المشرف العلمي: دكتوراه في العلوم البيولوجية البروفيسور بيرمان دانييل..."
"أخميدوفا فاطمة أخاتوفنا علماء العبارات اللفظية تكريس المشاعر في اللغات الروسية والإنجليزية والطاجيكية التخصص 10.02.20 - اللغويات التاريخية والتصنيفية والمقارنة ملخص الأطروحة للدرجة العلمية لمرشح العلوم اللغوية موسكو - 2013 1 تم إنجاز العمل في القسم لغات اجنبيةالمشرف العلمي على كلية فقه اللغة في رودن: أكاديمي MAN VS، ميخيفا ناتاليا فيدوروفنا دكتوراه في فقه اللغة..."
"زيادين ديا سامي فعالية زراعة القمح الربيعي في ظل أنظمة مختلفة لحراثة التربة الأساسية في الظروف الجافة في الأردن تخصص 06.01.01 - الزراعة العامة ملخص الأطروحة لدرجة مرشح العلوم الزراعية موسكو - 2009 1 العمل المنجز في مقهى دكتوراه في علوم التربة والزراعة، جامعة الصداقة بين الشعوب في روسيا. المشرف العلمي: مرشح العلوم التقنية البروفيسور فيكتور إيفانوفيتش تاغاسوف الرسمي..."
"Berezhnykh Elena Yurevna تسميات الألوان ورموزها في اللغتين الروسية والإسبانية 10/02/20 - اللغويات التاريخية والنموذجية والمقارنة ملخص الأطروحة لدرجة مرشح العلوم اللغوية كازان - 2009 2 تم الانتهاء من الأطروحة في قسم تاريخ اللغة الروسية واللغويات في المؤسسة التعليمية الحكومية للتعليم المهني العالي جامعة ولاية كازانسكي التي تحمل اسم V.I. أوليانوفا-لينينا المشرف العلمي: دكتوراه في فقه اللغة، البروفيسور جينادي..."
"إيساكوف غينادي ألكسندروفيتش تدريس الجريمة في دول القانون العام 12.00.08 - القانون الجنائي وعلم الجريمة؛ قانون التنفيذ الجنائي ملخص أطروحة درجة الدكتوراه في القانون موسكو - 2007 تم تنفيذ العمل في قسم القانون الجنائي بأكاديمية القانون الحكومية في موسكو. المستشار العلمي: عالم مشرف من الاتحاد الروسي، دكتور في القانون، البروفيسور أليكسي إيفانوفيتش راروج الرسمي..."
"MINEVA NATALYA ANATOLYEVNA الإنتاجية والصلابة الشتوية لمجموعات الجذور الأرضية من البرقوق في منطقة الأرض غير السوداء التخصص: 06.01.01 - الزراعة العامة ملخص الأطروحة لدرجة مرشح العلوم الزراعية موسكو - 2012 تم إنجاز العمل في الدولة المؤسسة العلمية اختيار عموم روسيا المعهد غير التكنولوجي للبستنة وزراعة الحضانة الأكاديمية الروسية للعلوم الزراعية (GNU VSTISP Rosselkhozakademii) العلمية..."
"أولغا بوريسوفنا زايتسيفا مشكلة إدارة سلامة أنظمة التشغيل التخصص 05.13.01 - تحليل النظام وإدارته ومعالجة المعلومات (الصناعة) ملخص الأطروحة لدرجة المرشح للعلوم الفيزيائية والرياضية موسكو 2011 تم الانتهاء من العمل في أكاديمية أرمافير التربوية الحكومية في قسم الجبر، والمشرف العلمي MPM: دكتور في العلوم الفيزيائية والرياضية، البروفيسور ف.أ.كاشتانوف رسمي..."
"UDC 581.14: 633.5.511: 577.34: 58.035 مافلانوفا سادباركون عبد الكريموفنا الخصائص الفسيولوجية والكيميائية الحيوية لمقاومة القطن المستحثة للآفات الحشرية المسببة للأمراض والممرضات VERTICILLUS WILTA 03.00.12 - Physi علم الأحياء والكيمياء الحيوية للنباتات ملخص الأطروحة للدرجة العلمية للمرشح العلوم البيولوجية طشقند - العمل المنجز في معهد علم وظائف الأعضاء..."
"تشكيل إيفجيني ألكسندروفيتش خروموف للمصالح الإدارية والإقليمية في قطاع النفط والغاز في اتحاد الجمهوريات الاشتراكية السوفياتية في 1957-1965. (استنادًا إلى مثال تطوير مقاطعة النفط والغاز في غرب سيبيريا) التخصص 07.00.02 - التاريخ المحلي ملخص الأطروحة لدرجة مرشح العلوم التاريخية تومسك - 2010 تم تنفيذ العمل في قسم الشؤون الاجتماعية والإنسانية تخصصات المؤسسة التعليمية الحكومية للتعليم المهني العالي، جامعة سورجوت التربوية الحكومية المشرف العلمي: دكتور... »
"Stebenkov Artem Mikhailovich الهيكل الإلكتروني وطيف الحالات أحادية الإلكترون من بلورات رباعي السطوح ذات العيوب المحلية 01.04.04 - الإلكترونيات الفيزيائية ملخص الأطروحة لدرجة مرشح العلوم الفيزيائية والرياضية فولغوغراد - 2009 تم إنجاز العمل في جامعة فولغوغراد التقنية الحكومية في المشرف العلمي على قسم الفيزياء دكتوراه في العلوم الكيميائية البروفيسور ليتنسكي أركادي أوفسيفيتش. المعارضون الرسميون: دكتور…”
"NURLYBAY SABIT تطوير نظام التحكم والتشخيص الفني لناقل الحزام الآلي 05.05.04 - آلات الطرق والبناء والرفع والنقل ملخص الأطروحة لدرجة مرشح العلوم التقنية جمهورية كازاخستان ألماتي ، 2010 تم تنفيذ العمل في جامعة كازاخستان آلاتاو. المشرف العلمي: دكتور في العلوم التقنية Dzhundibaev V.E. المستشار العلمي: مرشح العلوم التقنية تشينسيزباييف بكالوريوس...."
أول أكسيد الكربون، أو أول أكسيد الكربون (CO)، هو غاز عديم اللون والرائحة والمذاق. يحترق بلهب أزرق مثل الهيدروجين. ولهذا السبب، خلط الكيميائيون بينه وبين الهيدروجين في عام 1776 عندما أنتجوا أول أكسيد الكربون لأول مرة عن طريق تسخين أكسيد الزنك مع الكربون. ولجزيء هذا الغاز رابطة ثلاثية قوية، مثل جزيء النيتروجين. ولهذا السبب توجد بعض أوجه التشابه بينهما: فدرجات الانصهار والغليان متماثلة تقريبًا. يتمتع جزيء أول أكسيد الكربون بقدرة تأين عالية.
عندما يتأكسد أول أكسيد الكربون، فإنه يشكل ثاني أكسيد الكربون. يطلق هذا التفاعل كمية كبيرة من الطاقة الحرارية. ولهذا السبب يتم استخدام أول أكسيد الكربون في أنظمة التدفئة.
أول أكسيد الكربون في درجات الحرارة المنخفضة لا يتفاعل تقريبًا مع المواد الأخرى؛ أما في درجات الحرارة المرتفعة فإن الوضع مختلف. تتم تفاعلات الإضافة للمواد العضوية المختلفة بسرعة كبيرة. يعتبر خليط ثاني أكسيد الكربون والأكسجين بنسب معينة خطيراً جداً لاحتمالية انفجاره.
إنتاج أول أكسيد الكربون
في الظروف المختبرية، يتم إنتاج أول أكسيد الكربون عن طريق تحلل حمض الفورميك. ويحدث تحت تأثير حامض الكبريتيك المركز الساخن، أو عند مروره عبر أكسيد الفوسفور. هناك طريقة أخرى وهي تسخين خليط من أحماض الفورميك والأكساليك إلى درجة حرارة معينة. يمكن إزالة ثاني أكسيد الكربون المتطور من هذا الخليط عن طريق تمريره عبر ماء الباريت (محلول مشبع من هيدروكسيد الباريوم).
خطر أول أكسيد الكربون
أول أكسيد الكربون خطير للغاية على البشر. يسبب تسممًا شديدًا ويمكن أن يؤدي في كثير من الأحيان إلى الوفاة. والحقيقة هي أن أول أكسيد الكربون لديه القدرة على التفاعل مع الهيموجلوبين في الدم، الذي يحمل الأكسجين إلى جميع خلايا الجسم. ونتيجة لهذا التفاعل يتكون الكاربوهيموجلوبين. بسبب نقص الأكسجين، تعاني الخلايا من المجاعة.
ويمكن التعرف على أعراض التسمم التالية: الغثيان والقيء والصداع وفقدان رؤية الألوان وضيق التنفس وغيرها. يجب على الشخص الذي يعاني من التسمم بأول أكسيد الكربون أن يتلقى الإسعافات الأولية في أسرع وقت ممكن. أولاً عليك إخراجه إلى الهواء الطلق ووضع قطعة قطن مبللة بالأمونيا على أنفه. بعد ذلك، قم بفرك صدر الضحية ووضع كمادات التدفئة على ساقيه. وينصح بتناول الكثير من السوائل الدافئة. يجب عليك الاتصال بالطبيب مباشرة بعد اكتشاف الأعراض.
