الخواص الكيميائية للكربون. الكربون التقني وإنتاجه
§ 4.1. الخصائص العامة لعناصر مجموعة الكربون الفرعية
إلى العناصر الكيميائية المجموعة الفرعية الرئيسيةتشمل المجموعات الرابعة الكربونج، السيليكونسي, الجرمانيومجي، القصديرسن و يقودالرصاص. في السلسلة C - Si - Ge - Sn - Pb، ونظرًا لاختلاف الطبيعة الكيميائية للعناصر، فإنها تنقسم إلى مجموعتين فرعيتين: الكربون والسيليكون. مجموعة فرعية من الكربونالجرمانيوم والقصدير والرصاص - ألمانيا المجموعة الفرعية.
التكوينات الإلكترونية للطبقة الخارجية من ذرات العناصر نانوثانية 2 n.p. 2، في المركبات يمكن أن تظهر حالات الأكسدة من -4 إلى +4. كما هو الحال في المجموعة الفرعية الرئيسية للمجموعة الخامسة، لوحظ تغير في الخواص الكيميائية للعناصر: يظهر الكربون والسيليكون خصائص اللافلزات النموذجية، ويتميز الجرمانيوم بخصائص انتقالية، والقصدير والرصاص معادن نموذجية. كلما زاد العدد الذري في المجموعة الفرعية، تقل السالبية الكهربية للعناصر. ويتميز الكربون والسيليكون بمركبات تساهمية، بينما يتميز القصدير والرصاص بمركبات أيونية.
يتم عرض بعض خصائص عناصر المجموعة الفرعية الرئيسية للمجموعة الرابعة في الجدول. 4.1.
طاولة 4.1
خصائص العنصر
مجموعات فرعية من الكربون والمواد البسيطة
العدد الذري | الاسم، الرمز | نصف القطر الذري، نانومتر | إمكانية التأين، | منظمة أصحاب العمل | ستيبا لا | ص، | ر
رر
, | ر
بالة
, |
الكربون ج | 0,077 | 11,3 | 2,55 | –4, 0, +2, +4 | 3.52 الماس 2.27 جرافيت | 3730 | 4830 |
|
السيليكون سي | 0,117 | 8,2 | 1,90 | –4, 0, +2, +4 | 2,33 | 1410 | 2680 |
|
الجرمانيوم قه | 0,122 | 7,9 | 2,01 | –4, 0, +2, +4 | 5,33 | 937 | 2830 |
|
تين سن | 0,142 | 7,3 | 1,96 | –4, 0, +2, +4 | 7,29 | 232 | 2270 |
|
الرصاص ص | 0,154 | 7,4 | 2,33 | 0, +2, +4 | 11,3 | 327 | 1730 |
بيانات الجدول 4.1 تؤكد أنه في السلسلة C - Si - Ge - Sn - Pb يوجد تغير رتيب في الخواص من غير فلزية إلى فلزية. ويتجلى ذلك في انخفاض ثبات مركبات العناصر في حالة الأكسدة الأعلى +4 وزيادة في ثبات مركبات العناصر في حالة الأكسدة المنخفضة +2. لا تتميز C وSi وGe بتكوين كاتيونات حرة؛ حيث تشكل كاتيونات Sn وPb بسهولة Sn 2+ وPb 2+.
تتجلى الزيادة في الخواص المعدنية من خلال التغير في الخواص الحمضية القاعدية لأكاسيد وهيدروكسيدات العناصر في حالة الأكسدة +4 أثناء الانتقال من الكربون إلى الرصاص:
ثاني أكسيد الكربون | SiO2 | Geo2 | SnO2PbO2 |
خصائص الحمض | ضعيف | خصائص مذبذبة | خصائص مذبذبة |
تتغير الخواص الحمضية للهيدروكسيدات المقابلة بالمثل.
في السلسلة من الكربون إلى الرصاص، يزداد استقرار أكاسيد العناصر في حالة الأكسدة +2.
يوجد الكربون في الطبيعة على شكل نظيرين مستقرين: 12C (98.9%) و13C (1.1%).
وللنظير المشع ب للكربون 14C أهمية كبيرة. التعارف عن طريق الكربون المشعطريقة تحديد عمر الصخور المحتوية على الكربون هي حساب نسبة نسب نظائر الكربون المستقرة والمشعة.
الكربون هو الكربون الحادي عشر الأكثر وفرة على الأرض. يوجد في الغلاف الجوي على شكل ثاني أكسيد الكربون، وتتكون منه العديد من المعادن والصخور، مثل الطباشير، الحجر الجيري، الرخام (صيغته الكيميائية CaCO 3)، الدولوميت (MgCO 3 CaCO 3)، الملكيت ( كوكو 3 النحاس (أوه) 2). الكربون جزء من البروتينات والأحماض النووية والكربوهيدرات - المواد التي بدونها تكون الحياة مستحيلة.
في جميع المركبات تقريبًا (باستثناء CO وSiO)، يكون الكربون والسيليكون رباعي التكافؤ. تشكل ذرات الكربون في العديد من المركبات سلاسل –C–C. تتميز مركبات السيليكون أيضًا ببنية بوليمرية، ولكن على عكس ذرات الكربون، تشكل ذرات السيليكون سلاسل متفرعة، لا تتصل ببعضها البعض، ولكن من خلال الأكسجين –Si–O–Si–.
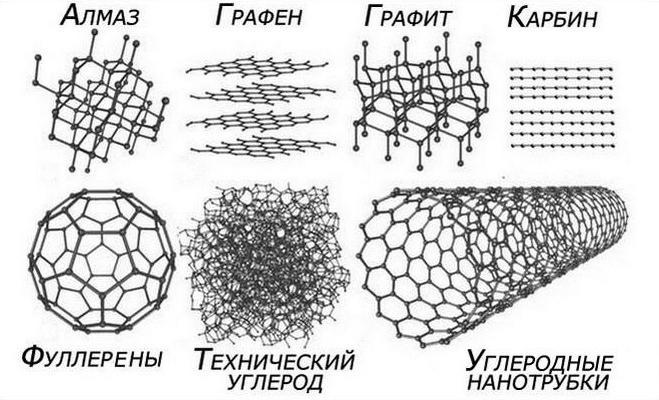
يشكل الكربون عدة مواد بسيطة: الماس، الجرافيت، الكارباين، الفوليرين والكربون غير المتبلور.
الماسهي بلورة عديمة اللون، شفافة، شديدة الانكسار للضوء، كثافتها 3.52 جم/سم3. يتم وصف هيكل مستوى الطاقة الخارجي لذرة الكربون في حالة غير مثيرة بالتكوين الإلكتروني 2 ق 2 2ص 2. عندما تتشكل روابط كيميائية في ذرة الكربون، توجد الإلكترونات ق-مستوى فرعي، ويكتسب التكوين 2 ق 1 2ص 3. تخضع مدارات الإلكترونات الأربعة غير المتزاوجة س 3- التهجين، مما يؤدي إلى تكوين أربعة مدارات هجينة متكافئة، الزاوية بينها تساوي رباعي السطوح. الذرات الموجودة في س 3-حالة هجينة، وتشكل بنية الماس. الماس هو مادة عالية القوة ذات صلابة فريدة وقوة انكسار ممتازة، وهو أمر مهم لصنع المواد الكاشطة، أدوات القطعوالمجوهرات.
الجرافيتعبارة عن كتلة زيتية رمادية معتمة، كثافتها 2.27 جم/سم3. في الجرافيت، توجد ذرات الكربون sp 2- الحالة الهجينة، والتي تحدد البنية الطبقية للجرافيت، والتي تتكون من أشكال سداسية مسطحة. إن المسافات بين ذرات الكربون الموجودة في الطبقات المختلفة تتجاوز المسافات بين الذرات داخل الطبقة. يفسر الهيكل الطبقي للجرافيت قدرته على توصيل الكهرباء والحرارة، بالإضافة إلى قدرته على ترك علامة على سطح صلب. لتحويل الماس إلى الجرافيت، من الضروري تسخينه إلى 1800-1850 درجة مئوية دون الوصول إلى الهواء. تحدث العملية العكسية عند درجة حرارة 3000 درجة مئوية وضغط 106–107 كيلو باسكال.
يستخدم الجرافيت على نطاق واسع كمادة القطب في الكيمياء الكهربائية. وهو جزء من مواد التشحيم ويستخدم كمهدئ للنيوترونات في المفاعلات النووية.
كاربينمسحوق بلوري أسود كثافته 1.9 جم/سم3. للحصول عليه، استخدم تفاعل نزع الهيدروجين من الأسيتيلين عند 1000 درجة مئوية، ونتيجة لذلك نتنتج جزيئات C 2 H 2 بوليمرًا ذو بنية خطية –C ْ C – C ْ C – C ْ C . في هذا التعديل، توجد ذرات الكربون sp- حالة هجينة.
الفوليرينتم العثور عليها في منتجات تكثيف بخار الجرافيت. يمثل جزيء الفوليرين C60 دورات مترابطة مكونة من خمسة وستة أعضاء تحتوي على الكربون في الحالة الهجينة sp2 وsp3. بالإضافة إلى C60، يتم فصل الفوليرينات ذات التركيبة C70 وC76.
الكربون غير المتبلور - التعديل الأكثر شيوعًا للكربون . في أغلب الأحيان يتم الحصول عليه من تحلل المواد العضوية المختلفة. ويسمى هذا النموذج أحيانًا بالفحم أو الكربون المنشط.
السيليكون- العنصر الأكثر وفرة بعد الأكسجين في القشرة الأرضية (27.6% بالكتلة). وله ثلاثة نظائر مستقرة: 28 Si (92.27%)، 29 Si (4.68%)، و30 Si (3.05%). في الطبيعة، تم العثور على السيليكون في النموذج السيليكا- أكسيد السيليكون (IV) SiO 2 (يسمى أحيانًا كوارتزأو رمل), السيليكاتو ألومينوسيليكاتعلى سبيل المثال الميكا KAl 3 (OH,F) 2، الأسبستوس (Mg,Fe) 6 (OH) 6، التلك Mg 3 (OH) 2. اعتمادًا على حجم الجسيمات ومحتوى الشوائب في SiO 2 أثناء اختزاله، يمكن الحصول على تعديلات مختلفة للسيليكون.
السيليكون غير المتبلور هو مسحوق بني كريستال- بلورات صلبة هشة ذات لون رمادي فاتح ذات مظهر معدني. في الشبكة البلورية، تكون كل ذرة سيليكون في حالة sp 3- التهجين ويحاط بأربع ذرات أخرى ويرتبط بها تساهميا - السيليكون البلوري يشبه الألماس.
يستخدم السيليكون على نطاق واسع في الإلكترونيات الدقيقة كمادة شبه موصلة للدوائر الدقيقة وفي علم المعادن لإنتاج المعادن النقية.
§ 4.2. الخواص الكيميائية للكربون والسيليكون
1. في التفاعلات مع المواد البسيطة التي تتكون من عناصر أكثر سالبية كهربية (الأكسجين والهالوجينات والنيتروجين والكبريت)، يظهر الكربون والسيليكون ملكيات عوامل التخفيض. عندما يتم تسخين الجرافيت والسيليكون مع وجود فائض من الأكسجين، يتم تشكيل أكاسيد أعلى، وعندما يكون هناك نقص في الأكسجين، يتم تشكيل أول أكسيد الكربون وSiO:
E + O 2 = EO 2 (الأكسجين الزائد)؛
2E + O 2 = 2EO (نقص الأكسجين).
يتفاعل الكربون والسيليكون مع الفلور عند الظروف العاديةمع تكوين رباعي فلوريد CF 4 وSiF 4، للحصول على رباعي كلوريد CCl 4 وSiCl 4، من الضروري تسخين المواد المتفاعلة. يتفاعل الكبريت والنيتروجين مع الكربون والسيليكون فقط عند التسخين القوي:
ج + 2S كس 2؛
2ج + ن 2 ج 2 ن 2 ;
سي + 2S سيس 2 .
عندما يتم تسخين خليط من رمل الكوارتز وفحم الكوك عند درجة حرارة حوالي 2000 درجة مئوية، يتكون كربيد السيليكون، أو كاربورندوم- مادة حرارية قريبة في صلابتها من الماس:
SiO 2 + 3C = SiC + 2CO.
غالبًا ما يستخدم الكربون لاختزال المعادن منخفضة النشاط من أكاسيدها ولتحويل كبريتات المعدن إلى كبريتيدات:
CuO + C Cu + CO،
BaSO 4 + 4C BaS + 4CO.
2. ردود الفعل مع الأحماض. الكربون والسيليكون مقاومان لعمل الأحماض العادية. يتأكسد الكربون بواسطة أحماض الكبريتيك والنيتريك المركزة:
C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O؛
3C + 4HNO 3 = 3CO 2 + 4NO + 2H 2 O.
يتم تخميل السيليكون الموجود في أحماض الكبريتيك والنيتريك المركزة ويذوب في مخاليط من أحماض النيتريك والهيدروفلوريك المركزة و: أحماض النيتريك والهيدروكلوريك المركزة
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O.
في هذا التفاعل، يلعب حمض النيتريك دور عامل مؤكسد، ويلعب حمض الهيدروفلوريك أو حمض الهيدروكلوريك دور عامل معقد.
3. ردود الفعل مع القلويات. يذوب السيليكون في المحاليل المائية للقلويات مع إطلاق الهيدروجين:
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2 H 2.
4. التفاعل مع الماء. في الظروف العادية، لا يتفاعل السيليكون مع الماء، ولكن عند درجات الحرارة المرتفعة يتفاعل مع بخار الماء:
Si + = H 2 SiO 3 + 2H 2 .
5. مؤكسد ملكياتيتجلى الكربون والسيليكون في التفاعلات مع المعادن النشطة، وبالتالي يتشكلان كربيداتو مبيدات السيليكا:
Ca + 2C = CaC 2 ;
2 ملغ + سي = ملغ 2 سي.
6. الكربون والسيليكون قادران غير متناسبعند تسخينها مع أكاسيد المعادن النشطة، وتشكيل أكاسيد وكربيدات ومبيدات السيليكات:
CaO + 3C = CaC 2 + CO؛
2Al 2 O 3 + 9C = Al 4 C 3 + 6CO؛
2MgO + 3Si = Mg2 Si + 2SiO.
§ 4.3. مركبات الأكسجين من الكربون والسيليكون
أكسيد الكربون (الثاني). ثاني أكسيد الكربون، أو أول أكسيد الكربون، في الظروف العادية هو غاز عديم اللون والرائحة، رر = -205 درجة مئوية، ر kip = = -191.5 درجة مئوية. وهو شديد السمية، ويحترق بلهب مزرق، وأخف من الهواء، وقابل للذوبان بشكل سيئ في الماء (2.3 مجلد من ثاني أكسيد الكربون لكل 100 مجلد من H 2 O عند 293 كلفن).
يتكون أول أكسيد الكربون عند حرق الكربون في غياب الأكسجين، بالإضافة إلى ذلك، يمكن الحصول على ثاني أكسيد الكربون عن طريق تفاعل الفحم الساخن مع بخار الماء أو ثاني أكسيد الكربون:
C + H 2 O CO + H 2 ;
ثاني أكسيد الكربون 2 + ج 2CO.
إيصال.في المختبريتم الحصول على ثاني أكسيد الكربون عن طريق تجفيف حمض الفورميك أو الأكساليك في وجود حمض الكبريتيك كعامل لإزالة الماء:
HCOH CO + H2O؛
ح 2 ج 2 يا 4 كو + كو 2 + ح 2 أو.
الخصائص الكيميائية. 1. عند تمرير أول أكسيد الكربون (II) إلى القلويات المنصهرة عند ضغط مرتفع، يتكون ملح حمض الفورميك:
CO + كوه = HCOOK.
هذا التفاعل، بالإضافة إلى الطريقة المختبرية لإنتاج ثاني أكسيد الكربون عن طريق تجفيف حمض الفورميك، يسمح لنا بافتراض أن ثاني أكسيد الكربون هو أنهيدريد حمض الفورميك.ومع ذلك، فإن هذا البيان رسمي بحت، حيث لا يمكن تنفيذ العملية العكسية للحصول على حمض الفورميك عن طريق ترطيب أول أكسيد الكربون.
حالة أكسدة الكربون في أول أكسيد الكربون - +2 - لا تتوافق مع بنية جزيء ثاني أكسيد الكربون، حيث بالإضافة إلى رابطتين تتشكلان عن طريق اقتران إلكترونات الكربون والأكسجين، هناك رابط آخر يتكون من المتلقي المانح آلية ناتجة عن زوج وحيد من إلكترونات الأكسجين (موضحة بالسهم):
يفسر وجود الرابطة الثلاثية قوة جزيء ثاني أكسيد الكربون وتفاعله المنخفض في درجات الحرارة العادية. في الظروف العادية، أول أكسيد الكربون لا يتفاعلمع الماء والقلويات والأحماض.
2. عند درجات الحرارة المرتفعة، يتفاعل ثاني أكسيد الكربون مع الأكسجين وأكاسيد المعادن:
2CO + O 2 = 2CO 2 ;
FeO + CO = Fe + CO 2.
3. عند تمرير خليط من أول أكسيد الكربون والكلور عبر الطبقة الكربون المنشطيمكنك الحصول على مادة سامة - غازات سامة الفوسجينالتسبب في شلل الجهاز التنفسي:
CO + Cl2 = COCl2.
4. عند تسخين أول أكسيد الكربون مع الهيدروجين عند ضغط مرتفع، يتكون كحول الميثيل:
CO + 2H 2 → C H 3 أوه.
الكربونيل.يتفاعل أول أكسيد الكربون (II) مع العديد من الفلزات الانتقالية لتكوين مركبات متطايرة - الكربونيل:
ني + 4CO = ني (CO) 4.
في جزيء ثاني أكسيد الكربون، تحتوي ذرة الكربون على زوج إلكترون وحيد، والذي يحدد الخصائص المانحة لهذا الجزيء. يتم تشكيل الرابطة التساهمية Ni-C في جزيء كربونيل النيكل بواسطة آلية المانح والمستقبل، مع تحول كثافة الإلكترون من ذرة الكربون إلى ذرة النيكل. يتم تعويض الزيادة في الشحنة السالبة على ذرة المعدن بمشاركتها د- الإلكترونات في تكوين الرابطة، وبالتالي فإن حالة أكسدة المعدن في الكربونيل هي صفر.
الكربونيلات المعدنية قابلة للذوبان في المذيبات غير القطبية وهي متطايرة. يتم استخدامها للحصول على معادن نقية لأنها عند تسخينها تتحلل إلى معدن وأول أكسيد الكربون (II). لتحديد تكوين الكربونيل، ما يسمى قاعدة 18 إلكترونًا:يجب أن يكون إجمالي عدد إلكترونات التكافؤ للمعدن والإلكترونات التي توفرها جزيئات ثاني أكسيد الكربون (2 من كل منهما) مساويًا لـ 18. لا يمكن للمعادن ذات العدد الذري الفردي أن تشكل غلافًا مكونًا من 18 إلكترونًا بهذه الطريقة، لذلك تتميز بأنها بوليمرية. (معظمها ديمريك) الكربونيلات، على سبيل المثال 2. في الكربونيلات الثنائية، تحدث رابطة فلزية معدنية وتقوم جزيئات ثاني أكسيد الكربون ببناء الرابطة.
يعتبر أول أكسيد الكربون CO عامل اختزال جيد لأملاح الفضة من محاليل الأمونيا لأملاحها:
2OH + CO = 2Ag↓ + (NH 4) 2 CO 3 + 2 NH 3
أكسيد السيليكون (II).يتم الحصول على SiO عن طريق التبخر المشترك في الفراغ لخليط من SiO 2 و Si عند درجة حرارة 1100-1300 درجة مئوية. لتقليل أكسيد SiO 2 إلى أول أكسيد SiO، يمكن أيضًا استخدام الهيدروجين أو الكربون؛ درجة حرارة 1000 درجة مئوية.
SiO 2 + H 2 = SiO + H 2 O؛
SiO 2 + C = SiO + CO.
أكسيد السيليكون (II) هو مسحوق بني يتأكسد بسرعة إلى ثاني أكسيد في الهواء. يذوب SiO بسهولة في القلويات وحمض الهيدروفلوريك.
يستخدم هذا المركب بشكل أساسي كصبغة للدهانات الزيتية وعامل تلميع.
أكسيد الكربون (الرابع). (ثاني أكسيد الكربون، ثاني أكسيد الكربون، أنهيدريد الكربونيك) CO2 هو غاز عديم اللون والرائحة ولا يدعم التنفس أو الاحتراق، وهو أثقل من الهواء، ر pl = -57 درجة مئوية عند ضغط 5 ضغط جوي، قابل للذوبان في الماء (88 مجلدًا من ثاني أكسيد الكربون في 100 مجلد من H 2 O عند 20 درجة مئوية). عند الضغط الطبيعي، يتحول ثاني أكسيد الكربون الصلب إلى الحالة الغازية، متجاوزًا الحالة السائلة ( مصعد). عند درجة الحرارة العادية وتحت ضغط 60 ضغط جوي، يتحول الغاز إلى سائل. جزيء ثاني أكسيد الكربون خطي، ويتكون من رابطتين مزدوجتين:
س=ج=س
في الصناعة للحصول على أول أكسيد الكربون (IV)، يتم استخدام تحلل الرخام بدرجة حرارة عالية:
كربونات الكالسيوم 3 كربونات الكالسيوم + ثاني أكسيد الكربون 2.
في المختبرللحصول على كميات كبيرة من ثاني أكسيد الكربون يستخدم حمض الهيدروكلوريك على الرخام:
CaCO 3 + 2HCl = CaCl 2 + H2O + CO2.
للكشف عن ثاني أكسيد الكربون المنطلق، يتم تمريره عبر ماء الجير، فيترسب راسب أبيض من كربونات الكالسيوم:
Ca(OH) 2 + CO 2 = CaCO 3 ¯ + H 2 O.
يجب أن نتذكر أنه في جو ثاني أكسيد الكربون، لا ينطفئ المغنيسيوم المضاء، ولكنه يستمر في الاحتراق:
2Mg + CO 2 = 2MgO + C
حمض الكربونيك يتكون H2CO3 بكميات صغيرة عندما يذوب ثاني أكسيد الكربون في الماء، وتوجد التوازنات التالية في المحلول:
H 2 O + CO 2 ↔ H 2 CO 3 ↔ H + + ↔ 2H + + .
عند 25 درجة مئوية ك 1 = 4 × 10 -7، ك 2 = 5 × 10 –11.حمض الكربونيك ضعيف جدًا وغير مستقر في شكله الحر. لديها الهيكل التالي:
باعتباره حمض ديباسيك، فإنه يشكل أملاح متوسطة ¾ كربوناتوالحامض ¾ الهيدروكربونات. عندما تعمل الأحماض القوية على أملاح حمض الكربونيك، يتم إطلاق ثاني أكسيد الكربون، والذي يستخدم ك رد فعل نوعيلهذه الأملاح:
NaHCO 3 + حمض الهيدروكلوريك = NaCl + CO 2 + H 2 O؛
BaCO 3 + 2HCl = BaCl 2 + CO 2 + H 2 O.
من بين جميع الكربونات، فقط كربونات الفلزات القلوية (Li 2 CO 3 هي الأقل قابلية للذوبان) والأمونيوم قابلة للذوبان في الماء. الهيدروكربونات الموجودة في معظم المعادن قابلة للذوبان بدرجة عالية في الماء.
تحت تأثير أول أكسيد الكربون الزائد (IV)، تتحول الكربونات غير القابلة للذوبان في الماء إلى بيكربونات قابلة للذوبان:
كربونات الكالسيوم 3 + H2O + CO2 = Ca(HCO3) 2.
عند تسخينها، تتحلل البيكربونات إلى كربونات وثاني أكسيد الكربون وماء:
2NaHCO 3 Na 2 CO 3 + H 2 O + CO 2.
جميع الكربونات، باستثناء كربونات الفلزات القلوية المستقرة حرارياً، تتحلل عند تسخينها إلى أكسيد فلز وثاني أكسيد الكربون:
كربونات الكالسيوم 3 كربونات الكالسيوم + ثاني أكسيد الكربون 2.
بالإضافة إلى الكربونات المتوسطة والحمضية، هناك معروفة أساسيكربونات. وتتكون من تأثير الكربونات المتوسطة على أملاح المعادن منخفضة النشاط:
2CuSO 4 + 3Na 2 CO 3 + 2H 2 O =
= Cu(OH) 2 CuCO 3 + 2NaHCO 3 + 2Na 2 SO 4.
كربونات النحاس الأساسية Cu(OH) 2 ·CuCO 3 معروفة في الطبيعة باسم "الملكيت".
من أملاح حمض الكربونيك، تعد صودا Na 2 CO 3 وهيدراتها البلورية المختلفة ذات أهمية عملية كبيرة: Na 2 CO 3 × 10H 2 O (الصودا البلورية)، Na 2 CO 3 × 7 H 2 O و Na 2 CO 3 × H. 2O، وكذلك البوتاس K2CO3، والطباشير، والحجر الجيري، والرخام، التي لها تركيبة CaCO3.
أكسيد السيليكون (الرابع).، أو السيليكا، SiO 2 ¾ مادة صلبة شديدة المقاومة للحرارة (نقطة انصهار أكثر من 1700 درجة مئوية)، توجد في الطبيعة على شكل معادن كوارتز, cristobaliteو ترايديميت.
في درجات الحرارة العادية، يعتبر الكوارتز تعديلا مستقرا مع زيادة درجة الحرارة، ويلاحظ تحولات متعددة الأشكال:
الكوارتز ترايديميت كريستوباليت تذوب.
بناء.في جميع تعديلاته، يكون ثاني أكسيد السيليكون دائمًا بوليمريًا (SiO 2) نوهي مبنية من رباعي الأسطح، مما يشكل شبكة ذرية قوية جدًا. كل ذرة سيليكون في بلورات (SiO 2) نمحاطة بأربع ذرات أكسجين، وهي تجسير وتترابط بزوايا مختلفة في رباعي الأسطح. ونتيجة لذلك، يتم تشكيل شبكة بلورية ثلاثية الأبعاد، حيث يحدد الموضع النسبي لرباعي الأسطح في الفضاء تعديلا أو آخر للسيليكا.
كوارتزيحدث بشكل طبيعي على شكل بلورات عديمة اللون جيدة التكوين تسمى الكريستال الصخري. وهناك أيضًا أنواع ملونة من الكوارتز: الكوارتز الوردي، والأرجواني ( جمشت) ، بني غامق (دخاني التوباز)، أخضر ( الكريسوبراسي). يسمى التعديل البلوري الدقيق للكوارتز مع شوائب المواد الأخرى العقيق الأبيض. أصناف العقيق هي العقيق واليشبإلخ. يتم استخدام الكريستال الصخري وأنواع الكوارتز الملونة كأحجار كريمة وشبه كريمة.
يستخدم الكوارتز على نطاق واسع في مختلف مجالات العلوم والتكنولوجيا والإلكترونيات الدقيقة، وغالبا ما يتم زراعته لتلبية احتياجات هذه الأخيرة. بلورات صناعيةمع بعض المعلمات شعرية الكريستال.
بعض بلورات الكوارتز قادرة على تدوير مستوى استقطاب الضوء، ويمكن أن تكون إما باليد اليمنى أو اليسرى. تختلف البلورات عن بعضها البعض كما يختلف الجسم عن صورته في المرآة. هذه البلورات هي الايزومرات الضوئية.
ترايديميتوجدت بكميات صغيرة في الصخور البركانية. ومن المعروف أيضًا أن Tridymite من أصل نيزكي. كريستوباليت، مثل الترايديميت، يحدث أحيانًا على شكل بلورات صغيرة مدمجة في الحمم البركانية. يتمتع الترايديميت والكريستوبالايت ببنية أكثر مرونة من الكوارتز. وبالتالي، فإن كثافة الكريستوباليت والتريديميت والكوارتز هي 2.32 على التوالي؛ 2.26 و 2.65 جم/سم3.
عندما يتم تبريد السيليكا المنصهرة ببطء، فإنها تتشكل غير متبلورزجاج الكوارتز. يوجد السيليكا أيضًا في الطبيعة على شكل زجاج. تبلغ كثافة الزجاج غير المتبلور 2.20 جم/سم3 - وهي أقل من كثافة جميع التعديلات البلورية. عند درجات حرارة أعلى من 1000 درجة مئوية، "يزيل" زجاج الكوارتز ويتحول إلى كريستوباليت، لذلك لا يمكن إجراء التجارب إلا في الأواني الزجاجية المختبرية المصنوعة من الكوارتز عند درجات حرارة أقل من 1000 درجة مئوية.
الخصائص الكيميائية. 1. جميع أشكال SiO 2 غير قابلة للذوبان عمليًا في الماء، فهي تتأثر فقط في الظروف العادية المحاليل القلوية، الفلور، غاز فلوريد الهيدروجينو حمض الهيدروفلوريك:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O؛
SiO 2 + 4HF = SiF 4 + 2H 2 O؛
SiO 2 + 6HF = H 2 + 2H 2 O.
يتم استخدام التفاعل الأخير في النقش على الزجاج.
2. ثاني أكسيد السيليكون - نموذجي أكسيد الحمضلذلك عند اندماجه يتفاعل مع الأكاسيد والقلويات والكربونات الأساسية لتكوين السيليكات:
SiO 2 + CaO = CaSiO 3؛
SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O؛
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2.
التفاعلات المذكورة أعلاه لثاني أكسيد السيليكون مع الأكاسيد والأملاح تكمن وراء الإنتاج الصناعي لمختلف المنتجات زجاج، وأيضا أسمنت.
زجاج.يتم الحصول على الزجاج العادي، الذي يحتوي على التركيبة Na 2 O × CaO × 6SiO 2، عن طريق دمج خليط من الصودا والرمل والحجر الجيري عند درجة حرارة حوالي 1400 درجة مئوية حتى تتم إزالة الغازات بالكامل:
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O × CaO × 6SiO 2 + 2CO 2.
وبإضافة أكاسيد الباريوم والرصاص والبورون يتم الحصول على أنواع خاصة من الزجاج، على سبيل المثال، مقاومة للحريق وغير قابلة للكسر. للحصول على النظارات الملونة، يتم استخدام أكاسيد فلزات انتقالية مختلفة، على سبيل المثال، إضافة أكسيد الكوبالت (III) Co 2 O 3 يعطي أزرق، أكسيد الكروم (III) Cr 2 O 3 ¾ الأخضر، وثاني أكسيد المنغنيز MnO 2 ¾ الوردي.
الاسمنت.تستخدم السيليكات على نطاق واسع في الإنتاج أسمنت- مادة رابطة تتصلب عند خلطها بالماء. يمكن التمييز بين نوعين من الأسمنت وفقًا لمبدأ تثبيتهما ¾ عاديالاسمنت و الاسمنت البورتلاندي. تحدث عملية تثبيت الأسمنت العادي بسبب تكوين كربونات الكالسيوم أثناء تفاعل ثاني أكسيد الكربون في الهواء مع سيليكات الكالسيوم:
CaSiO 3 + CO 2 + H 2 O = CaCO 3 ¯ + H 2 SiO 3 ¯.
يحدث وضع الأسمنت البورتلاندي نتيجة التحلل المائي للسيليكات مع تكوين هيدرات بلورية غير قابلة للذوبان:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca(OH) 2;
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4 × 4H 2 O ¯ .
أحماض السيليكات يتم الحصول عليها عن طريق عمل الأحماض المعدنية على محاليل السيليكات أو عن طريق التحلل المائي لهاليدات وكبريتيدات السيليكون، حيث أن التفاعل المباشر للسيليكا مع الماء مستحيل.
يمكن التعبير عن تركيبة أحماض السيليك بالصيغة العامة س SiO2 × ذح2أوه، أين سو ذ¾ هي أعداد صحيحة. في س = 1, ذ= 1: نحصل على SiO 2 × H 2 O أي H 2 SiO 3 ¾ ميتاسيليكون حامض; في س = 1, ذ= 2 - SiO 2 × 2H 2 O، أي H 4 SiO 4 ¾ أورثوحمض السيليك. في س = 2, ذ= 1 - 2SiO 2 × H 2 O، أي H 2 Si 2 O 5 ¾ ثنائي ميتا السيليكون حامض.
لو ذ> 2، يتم تصنيف الأحماض على أنها البولي سيليكون.
السيليكات -أملاح ميتاسيليكون، أو ببساطة حمض السيليك H 2 SiO 3. من هذه، تسمى فقط سيليكات الصوديوم والبوتاسيوم الزجاج السائل. ويستخدم الزجاج السائل لتقوية التربة ولصناعة صمغ السيليكات والأقمشة المقاومة للحريق. أما السيليكات المتبقية فهي عبارة عن ¾ مواد حرارية وغير قابلة للذوبان في الماء. عند تسخينه، يتحلل حمض السيليك:
ح 2 شافي 3 شافي 2 + ح 2 يا.
عند تخزينها في الهواء، تصبح محاليل السيليكات غائمة بسبب إزاحة حمض السيليكات بواسطة ثاني أكسيد الكربون الموجود في الهواء: حمض السيليكات أضعف من حمض الكربونيك؛ ثابت تفكك H 2 SiO 3 في الخطوة الأولى هو 2.2 × 10 –10.
تفاعل السيليكات مع ثاني أكسيد الكربون جودةالكشف عن أيونات السيليكات:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ¯.
المحاليل المائية للسيليكات القابلة للذوبان لها تفاعل قلوي للغاية بسبب التحلل المائي:
K 2 SiO 3 + H 2 O 2KOH + H 2 SiO 3 ¯ .
§ 4.4. الكربيدات ومبيدات السيليكا
تسمى مركبات الكربون والسيليكون التي تحتوي على عناصر أقل سالبية كهربية (غالبًا معادن). كربيداتو مبيدات السيليكا. بالإضافة إلى التفاعلات التي وردت معادلاتها أعلاه (انظر الفقرة 13.2)، يتم استخدام اندماج هيدريدات المعدن مع السيليكون للحصول على مبيدات السيليكات:
2CaH 2 + سي = كا 2 سي + 2H 2؛
اختزال المعادن من أكاسيدها بواسطة السيليكون أو الكربون في وجود أكسيد السيليكون:
2CaO + 3Si = 2CaSi + SiO 2؛
CaO + SiO 2 + 3C = CaSi + 3CO؛
تفاعل المعادن مع SiCl 4 في جو هيدروجيني:
Ba + SiCl 4 + 2H 2 = BaSi + 4HCl.
وتحدث كل هذه التفاعلات عند درجات حرارة عالية وأحيانا عند ضغط مرتفع.
من بين الكربيدات الأيونية هناك ما يسمى بالميثانيدات والأسيتيلينيدات. ميتانيدسيمكن اعتبارها مشتقات الميثان التي تحتوي على الكربون في حالة الأكسدة –4: Be 2 C, Al 4 C 3. تتحلل بسرعة مع الماء، وتطلق غاز الميثان:
Al 4 C 3 + 12H 2 O = 4Al(OH) 3 ¯ + 3CH 4.
الأسيتيلينيدات- مشتقات الأسيتيلين، حيث تكون حالة أكسدة الكربون -1: Li 2 C 2، Ag 2 C 2، Cu 2 C 2، CaC 2، Al 2 (C 2) 3، Fe 2 (C 2) 3. يتم تحضير أسيتيلينيدات الفضة والنحاس (I) عن طريق تمرير الأسيتيلين خلال محلول الأمونيا المكون من أكسيد الفضة أو كلوريد النحاس (I). الأسيتيلينيدات هي مواد شديدة الانفجار وتتحلل بسرعة بالماء والأحماض مع إطلاق الأسيتيلين:
CaC 2 + 2H 2 O = Ca(OH) 2 + C 2 H 2؛
CuC 2 + 2HCl = CuCl 2 + C 2 H 2.
§ 4.5. مركبات الهيدروجين من عناصر المجموعة الرابعة
دعونا نفكر فقط في مركبات الهيدروجين من السيليكون (السيلان)، والجرمانيوم (الجرمان)، والقصدير (الستانان)، والرصاص (البلومبين)، حيث سيتم وصف كيمياء مركبات الهيدروجين من الكربون في الكيمياء العضوية.
إيصال.عندما تتفاعل سيليكات المعادن النشطة (Mg, Ca, Li) مع الماء والأحماض، يتم إطلاق أبسط مركب هيدروجين في السيليكون - أحادي السيلان SiH 4، والذي يُطلق عليه غالبًا ببساطة سيلاني:
Ca2Si + 4HCl = 2CaCl2 + SiH4.
الطريقة الأكثر شيوعًا للحصول على مركبات تحتوي على الهيدروجين من عناصر المجموعة الرابعة هي تفاعل رباعي كلوريد العناصر مع رباعي هيدروألومينات الليثيوم:
GeCl 4 + Li [AlH 4] = GeH 4 + LiCl + AlCl 3
الهيكل والخصائص. تتشابه الهيدروسيليكات في تركيبها مع الهيدروكربونات. جزيء السيلاني له شكل رباعي السطوح منتظم مع ذرة السيليكون في المركز. السيلان هو غاز عديم اللون ذو رائحة عفنة يشتعل تلقائيا في الهواء. رر = -185 درجة مئوية، ركيب = -112 درجة مئوية سيلاني شديد السمية.
على عكس الميثان، يتفاعل السيلان مع المحاليل القلوية:
SiH 4 + 2KOH + H 2 O = K 2 SiO 3 + 4H 2.
يقوم الماء أيضًا بتحلل السيلان مائيًا، ولكن بشكل أبطأ بكثير:
SiH 4 + 2H 2 O = SiO 2 + 4H 2.
عند تسخينه فوق 400 درجة مئوية، يتحلل السيلان إلى السيليكون والهيدروجين، وتستخدم هذه الخاصية للحصول على السيليكون النقي:
سيه 4 = سي + 2 ح 2.
مثل الهيدروكربونات، تشكل السيلانات سلسلة متجانسة Si نح 2 ن+2. تم عزل Silanes حتى n = 14 بشكل فردي. مثل الألكانات، السيلانات عديمة اللون، والأعضاء الأولون في السلسلة المتماثلة يكونون غازيين في الظروف العادية، والـ ¾ التالية سائلة. النشاط الكيميائي للسيلان أعلى بكثير من نشاط الهيدروكربونات. ويرجع ذلك إلى انخفاض ألفة السيليكون للهيدروجين مقارنة بالكربون والألفة العالية جدًا للسيليكون للأكسجين، بالإضافة إلى انخفاض قوة رابطة Si – Si مقارنة بالرابطة C – C وانخفاض قوة الرابطة Si - ترجع رابطة Si أيضًا إلى السلسلة المتماثلة المحدودة من السيلان.
تعتبر السيلان والألمانية والستانان من عوامل الاختزال القوية:
SiH 4 + 2AgCl = SiH 3 Cl + HCl + 2Ag
§ 4.6. مركبات السيليكون مع الهالوجينات
يمكن اعتبار مركبات السيليكون مع الهالوجينات مشتقات من السيلان حيث يتم استبدال ذرات الهيدروجين كليًا أو جزئيًا بالهالوجين. يتم الحصول على رباعي هاليدات السيليكون مباشرة من مواد بسيطة. يحدث تفاعل السيليكون مع الفلور في درجات الحرارة العادية، مع الكلور والبروم واليود - عند تسخينه. عند مرور التيار SiF 4 عبر الماء، فإنه يتشكل هيدروفلوروسيليكحمض H2SiF6:
3SiF4 + 2H2O = SiO2 + 2H2 SiF6.
لم يتم عزل حمض الهيدروفلوروسيليك اللامائي. يعتبر محلوله المائي من أقوى الأحماض غير العضوية. تستخدم المحاليل المخففة كمطهر في صناعة المواد الغذائية. تستخدم أملاح حمض الهيدروفلوروسيليك القابلة للذوبان في تشريب جدران المباني المبنية من الكالسيوم. مواد البناء:
2CaCO 3 + MgSiF6 = SiO 2 + 2CaF 2 + MgF 2 + 2CO 2.
نتيجة للتفاعل، يتكون مسحوق SiO 2 الناعم، الذي يغلق جميع المسام ويجعل الجدران مقاومة للماء ومتينة.
§ 4.7. بعض ميزات عناصر مجموعة الجرمانيوم الفرعية
الجرمانيوميوجد في العديد من المعادن ولكن بكميات قليلة جداً ولهذا سمي بهذا الاسم عنصر متناثر. أهم معادن الجرمانيوم: الجرمانيتالنحاس 2 S × CuS × GeS 2، أرجروديتحج 8 جي إس 6, رينيريتالنحاس 3 (الحديد، قه)S 4.
المعادن الأساسية القصدير - حجر القصدير SnO2 ( حجر القصدير), يقود - جالينابرنامج تلفزيوني ( جالينا). يوجد الرصاص، باعتباره المنتج النهائي للتحلل الإشعاعي لليورانيوم، في معادن اليورانيوم.
في سلسلة Ge - Sn - Pb، يزداد نشاط المواد تجاه الأكسجين. في الظروف العادية، يكون Ge وSn مستقرين في الهواء، بينما يتأكسد الرصاص إلى أكسيد PbO.
يتفاعل القصدير والرصاص مع أحماض الهيدروكلوريك والكبريتيك المخففة لتحرير الهيدروجين، لكن الجرمانيوم لا يتفاعل مع الأحماض غير المؤكسدة.
يتأكسد الجرمانيوم بواسطة أحماض النيتريك والكبريتيك والهيدروفلوريك المركزة:
قه + 4H 2 SO 4 قه (SO 4) 2 + 2SO 2 + 4H 2 O؛
Ge + 6HF = H 2 GeF 6 + 2H 2 ;
Ge + 4HNO 3 = GeO 2 + 4NO 2 + 2H 2 O.
يذوب الجرمانيوم في الماء الملكي:
3Ge + 4HNO3 + 12HCl = 3GeCl4 + 4NO + 8H2O
وفي المحاليل القلوية في وجود عوامل مؤكسدة:
جي + 2NaOH + 2H2O2 = Na2.
عندما يتفاعل القصدير مع حمض النيتريك المركز، يتكون حمض القصدير H 2 SnO 3:
Sn + 4HNO 3 = H 2 SnO 3 + 4NO 2 + H 2 O.
في HNO3 المخفف، يتصرف القصدير مثل المعدن، ويشكل نترات القصدير (II):
3Sn + 8HNO 3 = 3Sn(NO 3) 2 + 2NO + 4H2O.
يعمل الرصاص في التفاعلات مع حمض النيتريك بأي تركيز كمعدن ويشكل نترات الرصاص الثنائي Pb(NO3)2.
من بين مركبات مجموعة الجرمانيوم الفرعية في حالة الأكسدة (IV)، يتميز أكسيد الرصاص بخصائص مؤكسدة فهو قادر على أكسدة الماء إلى أكسجين، أيون Mn + 2 إلى MnO 4 -:
2MnSO 4 + 5PbO 2 + H 2 SO 4 = 5PbSO 4 ↓ + 2HMnO 4 + 2H 2 O.
في سلسلة مركبات Ge (II) - Sn (II) - Pb (II)، تضعف خصائص الاختزال أقوى عوامل الاختزال هي مشتقات الجرمانيوم والقصدير:
Na + 2Bi(NO 3) 3 9NaOH = 2Bi↓+ 3 Na 2 ]Sn(OH) 6 ] + 6NaNO 3
ونعني بالكربون عنصر كيميائي، مع خصائص غير معدنية. ويرمز له بالحرف C ويعتبر عنصراً كيميائياً من المجموعة الرابعة من الدورة الثانية في الجدول الدوري لمندليف. عدده الذري 6 وكتلته الذرية 12.0107. اليوم، هناك عدة أنواع من تعديلات الكربون معروفة. الماس والجرافيت عبارة عن كربون، لكنهما يختلفان في بنية شبكتهما البلورية. هناك أيضًا الفوليرين والكارباين واللونسداليت الأقل شهرة، والذي تم العثور عليه في النيازك التي سقطت على الأرض. ويوجد الكربون أيضًا بكميات كبيرة جدًا في الفحم الذي يستخدم كوقود. كما أنها تستخدم لإنتاج أقطاب الكربون للأفران الصناعية، الخ.
الطرق الصناعية لتصنيع الكربون
هناك أربع طرق أكثر شيوعًا لإنتاج أسود الكربون اليوم. وهي تعتمد على التحلل الحراري التأكسدي للهيدروكربونات الغازية والسائلة. ومع ذلك، اعتمادًا على المواد الخام المستخدمة، هناك: طرق الفرن والمصباح والحرارة والقناة. يستثني الطرق الصناعيةهناك عدة طرق يمكن من خلالها إنتاج الكربون أيضًا.
إحدى الطرق الرائعة لصنع الكربون في المنزل هي صنع مركب الكربون باستخدام السكر. ستحتاج في هذه التجربة إلى تركيز حمض الكبريتيك والقفازات والسكر والماء وحمض الكبريتيك.
- قبل أن تحصل على الكربون، عليك أن تأخذ قارورة زجاجية.
- بعد ذلك، صب بعض السكر فيه.
- بعد ذلك، صب الماء في نفس القارورة. يجب أن تكون كمية الماء أعلى من مستوى السكر بمقدار سنتيمترين.
- بعد ذلك، يجب أن تكون حذرًا جدًا، لأنك ستتعامل مع حمض الكبريتيك.
- خذ حمض الكبريتيك المركز، ثم أضفه بحذر في قطرات صغيرة إلى نفس الدورق الذي يحتوي على السكر. بعد مرور بعض الوقت، سيتم تشكيل الكربون النقي في القارورة.
هناك أيضًا طريقة أخرى عند استخدام المطاط:
- خذ حاوية معدنية تحتوي أيضًا على غطاء محكم وأنبوب مخرج الغاز.
- بعد ذلك، قم بغمر قطعة من المطاط في هذه الحاوية.
- بعد ذلك، تحتاج إلى وضع الحاوية على موقد الغاز.
- يجب إنزال نهاية أنبوب مخرج الغاز في الجرة. أثناء التسخين بدون هواء، لن يحترق المطاط ويتحلل وستخرج الغازات (الميثان والهيدروكربونات السائلة) من أنبوب مخرج الغاز.
- بعد فترة من الوقت، من المفترض أن يتبقى لديك بعض الكربون في قاع الحاوية. سوف تحتوي صيغة هذا المركب على كمية كبيرة من C، أي الكربون.
الطريقة الأبسط هي الحصول على أول أكسيد الكربون. لاحظ أنه قبل أن تتمكن من الحصول على أول أكسيد الكربون، يجب أن يكون لديك إيثيلين بسيط. عندما يحترق (C 2 H 4 +3O 2 =2CO 2 +2H 2 O) سوف تحصل على أول أكسيد الكربون والماء.
يرجى ملاحظة: عند العمل مع الحمض، يجب عليك اتخاذ الاحتياطات اللازمة (ارتداء القفازات والنظارات الواقية). أثناء التحلل الحراري للمطاط، يجب إجراء هذه التجربة فقط في الهواء الطلق أو في منطقة جيدة التهوية.
خطة العمل:
مقدمة
هيكل ذرة الكربون.
التوزيع في الطبيعة.
تلقي الكربون.
البدنية و الخصائص الكيميائية.
الأهمية الاقتصادية الوطنية
الكربون في الجسم.
مراجع.
مقدمة
الكربون (lat. Carboneum)، C - العنصر الكيميائي للمجموعة الدورية الرابعة
نظام مندليف. هناك نظيران مستقران معروفان: 12C (98.892%) و13C
(1,108 %).
الكربون معروف منذ العصور القديمة. فحمخدم ل
انتشال المعادن من الخامات والماس مثل الحجر الكريم.
وبعد ذلك بكثير، بدأ استخدام الجرافيت لتصنيع البوتقات و
أقلام الرصاص.
في عام 1778، اكتشف K. Schele، عن طريق تسخين الجرافيت بالملح الصخري، أنه في هذه الحالة،
كما هو الحال عند تسخين الفحم بالملح الصخري، يتم إطلاق ثاني أكسيد الكربون.
تم تحديد التركيب الكيميائي للماس نتيجة للتجارب التي أجراها أ. لافوازييه
(1772) عن دراسة احتراق الماس في الهواء وبحث إس. تينانت
(1797) الذي أثبت أن كميات متساوية من الماس والفحم تعطي
أكسدة كميات متساوية من ثاني أكسيد الكربون. الكربون كمادة كيميائية
تم التعرف على العنصر فقط في عام 1789 من قبل أ. لافوازييه. الاسم اللاتيني
تلقى الكربونيوم الكربون من الكاربو - الفحم.
هيكل ذرة الكربون.
تزن نواة نظير الكربون الأكثر استقرارًا 12 (انتشار
98.9٪ لديها 6 بروتونات و 6 نيوترونات (12 نيوكليون)، مرتبة في ثلاثة
رباعيات تحتوي كل منها على بروتونين ونيوترونين، تشبه النواة
هيليوم النظير المستقر الآخر للكربون هو 13C (حوالي 1.1%) وبكميات ضئيلة
الكميات، النظير غير المستقر 14C موجود في الطبيعة مع فترة
عمر النصف 5730 سنة، يمتلك إشعاعًا. في الكربون العادي
في دورة المادة الحية، تشارك النظائر الثلاثة جميعها في شكل ثاني أكسيد الكربون. بعد الموت
للكائن الحي، يتوقف استهلاك الكربون ويمكن تأريخه
الأجسام المحتوية على C عن طريق قياس مستوى النشاط الإشعاعي 14C. انخفاض
- يتناسب إشعاع 14CO2 مع الوقت المنقضي منذ الوفاة.
في عام 1960، حصل دبليو ليبي على جائزة
جائزة نوبل.
في الحالة الأرضية، تشكل 6 إلكترونات من الكربون إلكترونًا
التكوين 1s22s22px12py12pz0. أربعة إلكترونات المستوى الثاني
هي التكافؤ، والذي يتوافق مع موقف الكربون في المجموعة IVA
النظام الدوري. منذ إزالة الإلكترون من الذرة في الغاز
تتطلب المرحلة طاقة عالية (حوالي 1070 كيلوجول/مول)، ولا يتشكل الكربون
الروابط الأيونية مع العناصر الأخرى، لأن ذلك يتطلب
إزالة الإلكترون لتكوين أيون موجب. وجود
السالبية الكهربية تساوي 2.5، ولا يظهر الكربون أي قوة
تقارب الإلكترون، وبالتالي لا يكون متقبلا نشطا
الإلكترونات. لذلك، فهو ليس عرضة لتشكيل جسيم سلبي
تكلفة. ولكن مع الطبيعة الأيونية جزئيا للرابطة، بعض المركبات
الكربون هناك، على سبيل المثال، كربيدات. في المركبات، يظهر الكربون
حالة الأكسدة 4. بحيث يمكن لأربعة إلكترونات المشاركة فيها
لتشكيل الروابط، فمن الضروري اقتران الإلكترونات 2S والقفز
واحد من هذه الإلكترونات لكل مدار 2pz؛ في هذه الحالة يتم تشكيل 4
روابط رباعية السطوح بزاوية بينهما 109 درجة. في المركبات هناك التكافؤ
يتم سحب إلكترونات الكربون منه جزئيًا فقط، لذلك الكربون
تشكل روابط تساهمية قوية بين الذرات المتجاورة من النوع C-C مع
باستخدام زوج الإلكترون المشترك. طاقة كسر هذه الرابطة هي 335
kJ/mol، بينما بالنسبة لرابطة Si-Si فهي 210 كيلوجول/مول فقط،
ولذلك، فإن السلاسل الطويلة –Si–Si– غير مستقرة. الطبيعة التساهمية للرابطة
يستمر حتى في مركبات الهالوجينات شديدة التفاعل مع
الكربون، CF4 وCCl4. ذرات الكربون قادرة على توفير
تكوين رابطة لأكثر من إلكترون واحد من كل ذرة كربون؛ لذا
يتم تشكيل روابط مزدوجة C=C وثلاثية C؟C. عناصر أخرى أيضا
تشكل روابط بين ذراتها، لكن الكربون وحده هو القادر على ذلك
تشكل سلاسل طويلة. ولذلك، فإن الآلاف معروفة بالكربون
مركبات تسمى الهيدروكربونات، والتي يرتبط بها الكربون
الهيدروجين وذرات الكربون الأخرى، وتشكل سلاسل طويلة أو
الهياكل الحلقية.
ومن الممكن في هذه المركبات استبدال الهيدروجين بذرات أخرى معظمها
في كثير من الأحيان على الأكسجين والنيتروجين والهالوجينات مع تكوين العديد من المواد العضوية
اتصالات. ومن أهمها مركبات الفلوروكربون -
الهيدروكربونات التي يتم فيها استبدال الهيدروجين بالفلور. مثل هذه الاتصالات
خاملة للغاية، ويتم استخدامها كالبلاستيك ومواد التشحيم
المواد (الفلوروكربونات، أي الهيدروكربونات التي تحتوي على جميع ذرات الهيدروجين
استبدالها بذرات الفلور) وكمبردات ذات درجات حرارة منخفضة (الفريون،
أو الفريونات، – مركبات الكربون الكلورية فلورية).
التوزيع في الطبيعة:
تحتوي ذرة الكربون على أربعة إلكترونات في AOs الأربعة الخارجية.
لذلك، تشارك جميع AOs الأربعة في تكوين الروابط الكيميائية.
وهذا ما يفسر تنوع ووفرة مركبات الكربون.
الغالبية العظمى من مركبات الكربون تنتمي إلى ما يسمى
المواد العضوية. في هذا القسم سوف ننظر في الخصائص
المواد غير العضوية التي يتكونها الكربون - مواد بسيطة
أكاسيده وحمض الكربونيك وبعض أملاحه.
يشكل الكربون عدة مواد بسيطة. ومن بينها، الأهم حتى الآن
يعتبر الماس والجرافيت. هؤلاء تعديلات تآصليةلديك الذرية
الشبكات البلورية التي تختلف في بنيتها. من هنا
الفرق بين خصائصها الفيزيائية والكيميائية.
في الماس، ترتبط كل ذرة كربون بأربع ذرات أخرى. في
وفي الفضاء، تقع هذه الذرات في مركز وزوايا رباعي الاسطح،
متصلة بواسطة قممها. هذه شبكة متناظرة ومتينة للغاية.
الماس هو أصلب مادة على وجه الأرض.
في الجرافيت، ترتبط كل ذرة بثلاث ذرات أخرى تقع في نفس المكان
طائرة. ويتطلب تكوين هذه الروابط ثلاث شركات مساهمة مع ثلاث
الإلكترونات. يقع المدار الرابع 2p-AO بإلكترون واحد
عمودي على الطائرة. هذه المدارات الذرية المتبقية من الشبكة بأكملها
تتداخل مع بعضها البعض لتشكل منطقة من المدارات الجزيئية. هذه المنطقة
ليست مشغولة بالكامل، بل نصفها، مما يوفر المعدن
الموصلية الكهربائية للجرافيت (على عكس الماس).
بالإضافة إلى التوصيل الكهربائي، يحتوي الجرافيت على ثلاثة أشياء أكثر أهمية من الناحية العملية
ملكيات.
أولا، الحراريات. هل درجة انصهار الجرافيت أعلى من 3500؟ مع -
إنها المادة البسيطة الأكثر مقاومة للحرارة على وجه الأرض.
ثانياً: عدم وجود أي منتجات على سطحه
التفاعل مع بيئة(على المعادن هذه أكاسيد)،
زيادة المقاومة الكهربائية.
ثالثا، القدرة على أن يكون لها تأثير التشحيم على فرك
الأسطح. في بلورة الجرافيت، ترتبط ذرات الكربون بشكل وثيق فيما بينها
نفسها في شبكات مسطحة، والاتصال بين الشبكات ضعيف، فقد حدث ذلك
طبيعة بين الجزيئات، كما هو الحال في المواد ذات الشبكات الجزيئية.
لذلك، حتى القوى الميكانيكية الصغيرة تسبب إزاحة الشبكة
بالنسبة لبعضها البعض، وهو ما يحدد تأثير الجرافيت كمادة تشحيم.
طاقة الرابطة بين ذرات الكربون في المواد البسيطة والمعقدة
بما في ذلك الماس والجرافيت. كبير جدًا. حول صلابة الماس بالفعل
تحدث. الرابطة بين الذرات قوية أيضًا في شبكة الجرافيت. لذا،
قوة الشد لألياف الجرافيت أعلى بكثير من قوة الشد
الحديد والصلب التقني.
يتم تصنيع ما يسمى بالمواد المركبة على أساس الجرافيت.
وعلى وجه الخصوص، البلاستيك المقوى بألياف الكربون، حيث توجد ألياف الجرافيت على المصفوفة
من راتنجات الايبوكسي. يتم استخدام المواد المركبة بشكل متزايد في
تكنولوجيا الطيران والفضاء (بعد كل شيء، بالإضافة إلى القوة، فهي خفيفة الوزن؛
دعونا نقارن كثافة الجرافيت، p=2.3 جم/سم3، بكثافة الألومنيوم "الخفيف"،
p = 2.7 جم/سم3، وأكثر من ذلك بالنسبة للحديد، p = 7.9 جم/سم3)، وكذلك في بناء السفن، حيث
تعتبر مقاومة التآكل ذات قيمة خاصة.
مركبات الكربون
أول أكسيد الكربون (1U) حمض الكربونيك
لديها تعديلات متآصلة: الماس، الجرافيت، كاربين، الفوليرين، الخ.
يظهر الخصائص التصالحية
الحروق في الأكسجين: C+O2=CO2+Q
يتفاعل مع أول أكسيد الكربون (1U): C+CO2=2CO
يستعيد المعادن من أكاسيدها: 3C+Fe2O3=3CO2+4Fe
إيصال
الاحتراق غير الكامل للميثان: CH4+O2=C+2H2O غاز عديم الرائحة، عديم اللون والطعم،
أثقل من الهواء
أكسيد الحمض
عند ذوبانه يتفاعل مع الماء: CO2+H2O=H2CO3
يتفاعل مع القواعد:
CO2+Ca(OH)2=CaCO3+H2O
5. يتفاعل مع الأكاسيد الأساسية:
6. تشكلت في ردود الفعل
أ) احتراق الكربون في الأكسجين:
ب) أكسدة أول أكسيد الكربون (II):
ب) احتراق الميثان:
CH4+O2=CO2+2H2O
د) تفاعل الأحماض مع الكربونات:
CaCO3+2HCI=CaCI2+CO2+H2O
د) التحلل الحراري للكربونات والبيكربونات:
2NaHCO3=Na2CO3+CO2+H2O
ه) أكسدة العمليات البيوكيميائية للتنفس والتحلل.
1. جزيء غير مستقر. حمض ديباسيك ضعيف. في محلول مائي
هناك توازنات.
2. يتفاعل مع المحاليل القلوية مثل محلول ثاني أكسيد الكربون
الماء مع تكوين الأملاح الحمضية (الهيدروكربونات) والمتوسطة
(الكربونات):
CO2+هيدروكسيد الصوديوم=NaHCO3
CO2+2NaOH=Na2CO3+
3. تحل محل الأملاح أحماض أقوى
CaCO3+2HCI=CaCI2+CO2+H2O
4. أملاح حمض الكربونيك تخضع للتحلل المائي
الكربون خامل كيميائيا فقط عند درجات حرارة منخفضة نسبيا، و
عند المستويات العالية فهو أحد أقوى عوامل الاختزال. الكيميائية الرئيسية
استخدام الكربون – اختزال المعادن، وخاصة الحديد،
من الخامات
أكاسيد الكربون.
وجود أربعة إلكترونات في مستوى الطاقة الخارجي، والكربون في
المركبات مع الأكسجين، اعتمادا على الظروف، يظهر التكافؤ
+2 و +4.
عند حرق المواد المحتوية على الكربون (الخشب والفحم والغاز الطبيعي
الميثان والكحول وما إلى ذلك) عند درجة حرارة اللهب الطبيعي يحدث التفاعل:
ج + O2 = ثاني أكسيد الكربون
ولكن إذا قمت بتهيئة الظروف لزيادة درجة الحرارة (على سبيل المثال، تقليل
إزالة الحرارة، والتي يمكن أن تحدث داخل طبقة سميكة من الفحم المحترق، في
بما في ذلك في الفرن العالي)، ثم تحدث التفاعلات التالية:
ج + O2 = 2CO
CO2 + C = 2CO
ناتج الاحتراق الكامل للكربون والمواد التي تحتوي عليه
أول أكسيد الكربون (1U) CO2 – ثاني أكسيد الكربون. تتشكل أثناء التنفس
الكائنات الحية وتحلل بقاياها. وفي الوقت نفسه ثاني أكسيد الكربون
(مع الماء) هي المادة الرئيسية التي تستهلكها النباتات فيها
عملية نموهم.
مع زيادة الضغط بالفعل في درجة حرارة الغرفةثاني أكسيد الكربون
يسيل. تمتلئ بعض أنواع طفايات الحريق بغاز ثاني أكسيد الكربون السائل.
ومع انخفاض الضغط، يغلي أول أكسيد الكربون السائل. وفي نفس الوقت له
تنخفض درجة الحرارة بشكل حاد، حيث تتشكل المسام، كما هو معروف،
من الفيزياء، يتم إنفاق كمية كبيرة من الحرارة. نتيجة لثاني أكسيد الكربون
يصلب. يتم استخدامه في شكل صلب (يسمى "الثلج الجاف").
كمبرد. عند الضغط الجوي، لا يحدث الثلج الجاف
يذوب، ومثل اليود والفوسفور والكربون، فإنه يتسامى فقط عندما
درجة حرارة أقل بكثير (-75 درجة مئوية).
متوسط محتوى الكربون في القشرة الأرضية هو 2.3*10-2% بالكتلة (1*10-2 بوصة)
فوق قاعدي، 1*10 –2 أساسي، 2*10 –2 متوسط، 3*10 –2 حمضي
الصخور). يتراكم الكربون في الجزء العلوي من القشرة الأرضية
(المحيط الحيوي): 18% كربون في المادة الحية، 50% في الخشب، 50% في الحجر
الفحم 80%، النفط 85%، الأنثراسيت 96%. إذن جزء من الكربون
يتركز الغلاف الصخري في الحجر الجيري والدولوميت.
عدد معادن الكربون الخاصة بها - 112؛ عدد كبير بشكل استثنائي
مركبات الكربون العضوية - الهيدروكربونات ومشتقاتها.
ويرتبط تراكم الكربون في القشرة الأرضية بتراكم العديد من العناصر الأخرى
العناصر التي تمتصها المادة العضوية وتترسب في الشكل
كربونات غير قابلة للذوبان، الخ.
بالمقارنة مع متوسط المحتوى الموجود في القشرة الأرضية، فإن الإنسان في
يستخرج الكربون من باطن الأرض بكميات كبيرة بشكل استثنائي (الفحم،
النفط والغاز الطبيعي) لأن هذه الحفريات هي المصادر الرئيسية للطاقة.
ينتشر الكربون أيضًا على نطاق واسع في الفضاء؛ على الشمس تحتل المرتبة الرابعة
مكان بعد الهيدروجين والهيليوم والأكسجين.
إنتاج الكربون
التقطير الجاف
خشب
الفحم
فحم
فحم الكوك
الكربون المنشط
أنقى الكربون هو السخام
الخصائص الكيميائية
غير نشط، في البرد - فقط مع F2 (CF4
عامل مختزل (معبر عنه بشكل ضعيف (مؤكسد
1) O2 + C (CO2 أقل من 500(C (
(تضيء
CO2 + C (CO أعلى من 900(C)
2) H2O + C (CO + H2 فوق 1200 (C
2H2O + C (CO2 + CO2 + H2 فوق 1000 (C
3) CuO + C (Cu + CO عند (t
Cu+2 +2e(Cu0 – عامل مؤكسد، مخفض
C0 -2e(C+2 هو عامل اختزال، يتأكسد
4) HNO3 + 3C (3 CO2 + 4 NO + 2 H2O).
مع H2SO4 المخفف
Cu+2 +2e(Cu0 – عامل مؤكسد، مخفض
C0 -2e(C+2 هو عامل اختزال، يتأكسد
1) Ca + 2C (Ca (((كربيد الكالسيوم
C + Si (CSi carborundum
طريقة أخرى:
CaO + C (CaC2 + CO
2) 2H2 + C (C-4H+4
دعونا نفكر من وجهة نظر الثور الأحمر:
4H0 -4e(4H+ – عامل اختزال، يتأكسد
C0 +4e(C-4 – عامل مؤكسد، مخفض
يمكن أن يكون الكربون عاملاً مؤكسدًا وعامل اختزال.
أول أكسيد الكربون (الرابع)
عديم اللون والرائحة، قابل للذوبان في الماء؛ -76(ج – الثلج الجاف؛ الاستلام: في
صناعة تحميص الحجر الجيري
CaCO3 (CaO + CO2)
في المختبر - إزاحة الحمض القوي CaCO3 + 2HCl (CaCl2+
يتم التعبير عن خصائص الأكسدة بشكل ضعيف: فقط في درجات الحرارة المرتفعة،
مع المعادن، الألفة للأكسجين أكبر من C (Mg، K)
2 ملغ + CO2 (2MgO + C
أكسيد الحمض عند إذابته في الماء تتكون كمية صغيرة منه
حمض الكربونيك
1. 2NaOH + CO2 (
Na2CO3 + H2O + CO2 (
ويمكن الحصول على أملاح حمض الكربونيك باستخدام هذه الطريقة. طريقة أخرى:
2. تبادل رد الفعل
BaCl2 + Na2CO3 (
(BaCO3(+2NaCl
الأملاح: 1) كربونات، قابلة للذوبان في الماء - قلوية فقط وNH+4 قوية
التحلل المائي.
عند تسخين Ca(HCO3)2 (CaCO3 +).
CaCO3 (CO2 + CaO
تذوب كربونات الفلزات القلوية دون أن تتحلل.
رد فعل نوعي
"الغليان" - حمض قوي
CaCO3 + 2HCl (CaCl2+
ثاني أكسيد الكربون يسبب تعكر ماء الجير والباريت Ca(OH)2 +
ثاني أكسيد الكربون (CaCO3 + H2O
يؤدي الذوبان إلى تدمير جبال الحجر الجيري القديمة.
CaCO3 + H2O + CO2 ((Ca(HCO3)2 أول أكسيد الكربون (II)
ثاني أكسيد الكربون (أول أكسيد الكربون)
غاز عديم اللون، عديم الرائحة، سام لأنه... يرتبط بالهيموجلوبين
دم. ضعيف الذوبان في الماء. الحصول على: الاحتراق مع نقص O2
2CH4 + 3O2 (2CO(+
في المختبر: يتركز العمل. H2SO4
HCOH (CO(+ H2O
حمض الأكساليك H2C2O4 (CO(+ CO2(+
اختزال Fe2O3 +
3CO (2Fe + 3CO2)
O2 + 2CO (2CO2(
لا يشكل الملح، ولكن عند t = 200(C، 20 atm
O – Na المركبات العضوية كربيدات CH4 – متحصل عليها
في التفاعل المباشر مع المعادن.
2 مجموعات.
I. كربيدات معدنية. الانتقالي Me + C. إلكتروني
الموصلية، بريق معدني.
ثانيا. الكربيدات الأيونية أكثر إيجابية للكهرباء، عديمة اللون، شفافة،
لا تجري التيار الكهربائي.
1) Al4C3 + 12H2O (
(4Al(OH)3 + 3CH4(
C Be2C – نفس رد الفعل
2) CaC2 + 2H2O (
(الكالسيوم(OH)2 + C2H2(
Na2C2؛ K2C2؛ SrC2؛ بك2؛ Cu2C2
أثناء التحلل المائي - الأسيتيلين والهيدروكربونات غير المشبعة من Mg2C2؛ Fe3C،
اللانثانيدات.
الخصائص الفيزيائية والكيميائية:
هناك أربعة تعديلات بلورية معروفة للكربون: الجرافيت، والماس،
كاربين ولونسديليت. الجرافيت - رمادي-أسود، معتم، جريء
الملمس، متقشر، كتلة ناعمة جدًا ذات لمعان معدني. في
درجة حرارة الغرفة والضغط الطبيعي (0.1 مليون نيوتن/م2، أو 1 كجم/سم2)
الجرافيت مستقر ديناميكيًا حراريًا. الماس - صلب جدًا، بلوري
مادة. تحتوي البلورات على شبكة مكعبة مركزية الوجه:
a=3.560(. في درجة حرارة الغرفة والضغط الطبيعي، الماس
شبه مستقر. لوحظ تحول ملحوظ في الماس إلى الجرافيت
درجات حرارة أعلى من 1400 (م في الفراغ أو في جو خامل. في
الضغط الجوي ودرجة الحرارة حوالي 3700 (تسامي الجرافيت.
يمكن الحصول على الكربون السائل عند ضغوط أعلى من 10.5 مليون/م2 (1051
كجم ق/سم2) ودرجات حرارة أعلى من 3700 (م. بالنسبة للكربون الصلب (فحم الكوك، والسخام،
الفحم) يتميز أيضًا بحالة ذات بنية مضطربة
الكربون "غير المتبلور" والذي لا يمثل ذرة مستقلة
التعديلات؛ يعتمد هيكلها على هيكل البلورات الدقيقة
الجرافيت تسخين بعض أصناف الكربون "غير المتبلور" بدرجة أعلى
1500-1600(C بدون وصول الهواء يؤدي إلى تحولها إلى الجرافيت.
تعتمد الخصائص الفيزيائية للكربون "غير المتبلور" بشكل كبير
تشتت الجسيمات ووجود الشوائب. الكثافة، السعة الحرارية،
الموصلية الحرارية والكهربائية للكربون "غير المتبلور" تكون دائمًا أعلى،
من الجرافيت. يتم الحصول على كارباين بشكل مصطنع. إنه يمثل
مسحوق أسود بلوري ناعم (الكثافة 1.9 - 2 جم/سم3).
تتكون من سلاسل طويلة من ذرات الكربون C مرتبة بالتوازي مع بعضها البعض.
تم العثور على اللونسداليت في النيازك ويتم الحصول عليه بشكل مصطنع؛ هيكلها و
لم يتم تحديد الخصائص بشكل نهائي.
تكوين الغلاف الخارجي لذرة الكربون هو 2s22p2. للكربون
تتميز بتكوين أربع روابط تساهمية بسبب
إثارة غلاف الإلكترون الخارجي إلى الحالة 2sp3. لهذا السبب
الكربون قادر على الجذب والإطلاق بنفس القدر.
الإلكترونات. يمكن أن تحدث الروابط الكيميائية من خلال sp3-، sp2- و
المدارات الهجينة sp، والتي تتوافق مع أرقام التنسيق 4.3
و 2. عدد إلكترونات التكافؤ الكربونية وعدد مدارات التكافؤ
بالتساوي؛ وهذا أحد أسباب ثبات الرابطة بين ذرات الكربون.
القدرة الفريدة لذرات الكربون على التواصل مع بعضها البعض
أدى تكوين سلاسل ودورات قوية وطويلة إلى ظهورها
تمت دراسة عدد كبير من مركبات الكربون المختلفة
الكيمياء العضوية.
في المركبات، يظهر الكربون حالة أكسدة تبلغ -4؛ +2؛ +4. الذري
نصف القطر 0.77(، نصف القطر التساهمي 0.77)، 0.67(، 0.60(على التوالي في
سندات مفردة ومزدوجة وثلاثية. نصف القطر الأيوني C4- 2.60(، C4+ 0.20(.
في الظروف العادية، يكون الكربون خاملًا كيميائيًا عند درجات الحرارة المرتفعة
فهو يجمع مع العديد من العناصر، مما يظهر خصائص ترميمية قوية
ملكيات.
جميع أشكال الكربون مقاومة للقلويات والأحماض وتتأكسد ببطء
فقط عوامل مؤكسدة قوية جدًا (خليط الكروم، خليط مركز
HNO3 وKCIO3، وما إلى ذلك). يتفاعل الكربون "غير المتبلور" مع الفلور في درجة حرارة الغرفة
درجة الحرارة والجرافيت والماس - عند تسخينها. اتصال مباشر
يحدث الكربون مع الكلور في قوس كهربائي. مع البروم واليود
لا يتفاعل الكربون، وهاليدات الكربون عديدة
توليفها بشكل غير مباشر. من أوكسي هاليدات الصيغة العامة COX2 (حيث
عاشراً - الهالوجين) وأشهرها أوكسي كلوريد COCI2 (الفوسجين).
عند درجات حرارة أعلى من 1000 (مئوية)، يتفاعل الكربون مع العديد
المعادن، وإعطاء كربيدات. جميع أشكال الكربون عند تسخينه
اختزال أكاسيد الفلزات لتكوين فلزات حرة (Zn,
Cd، Cu، Pb، إلخ) أو الكربيدات (CaC2، Mo2C، WC، TaC، إلخ). الكربون
يتفاعل عند درجات حرارة أعلى من 600 - 800 (م) مع بخار الماء وثاني أكسيد الكربون
غاز.
جميع أشكال الكربون غير قابلة للذوبان في المواد العضوية وغير العضوية العادية
المذيبات، ولكنها تذوب في بعض المعادن المنصهرة
(على سبيل المثال الحديد، ني، كو).
الأهمية الاقتصادية الوطنية:
يتم تحديد الكربون من خلال حقيقة أن أكثر من 90٪ من جميع المصادر الأولية
الطاقة المستهلكة في العالم تأتي من الوقود الأحفوري،
والتي سيستمر دورها المهيمن خلال العقود القادمة،
رغم التطور المكثف للطاقة النووية. حوالي 10% فقط
ويستخدم الوقود المستخرج كمادة خام للصناعة الرئيسية
التوليف العضوي والتوليف البتروكيميائي للحصول عليه
كتل بلاستيكية، الخ.
الكربون في الجسم:
الكربون هو العنصر الحيوي الأكثر أهمية الذي يشكل أساس الحياة عليه
الأرض، وحدة هيكلية لعدد كبير من المركبات العضوية،
المشاركة في بناء الكائنات الحية وضمان وظائفها الحيوية
(البوليمرات الحيوية، بالإضافة إلى العديد من المركبات البيولوجية ذات الجزيئات المنخفضة
المواد الفعالة - الفيتامينات والهرمونات والوسطاء وما إلى ذلك). بارِز
يتم إنتاج بعض الطاقة التي تحتاجها الكائنات الحية في الخلايا بسبب
أكسدة الكربون. يعتبر ظهور الحياة على الأرض في
العلم الحديث كعملية معقدة لتطور مركبات الكربون.
يعود الدور الفريد للكربون في الطبيعة الحية إلى خصائصه،
والتي لا يمتلكها في مجملها أي عنصر آخر من الفترة الدورية
أنظمة. بين ذرات الكربون، وبين الكربون وغيره
تشكل العناصر روابط كيميائية قوية، ومع ذلك، يمكنها ذلك
يتم كسرها في ظل ظروف فسيولوجية معتدلة نسبيًا (هذه الروابط
يمكن أن تكون مفردة أو مزدوجة أو ثلاثية). قدرة الكربون
تشكل 4 روابط تكافؤ مكافئة مع الذرات الأخرى. الكربون
يخلق الفرصة لبناء هياكل عظمية كربونية بمختلف أنواعها -
خطية، متفرعة، دورية. ومن المهم أن ثلاثة فقط
العناصر - C، O، H - تشكل 98٪ من الكتلة الإجمالية للكائنات الحية. هذا
يتم تحقيق كفاءة معينة في الطبيعة الحية: عمليًا
تنوع هيكلي لا حدود له لمركبات الكربون الصغيرة
يسمح لك عدد أنواع الروابط الكيميائية بتقليل العدد بشكل كبير
الإنزيمات اللازمة لتكسير وتخليق المواد العضوية.
تكمن السمات الهيكلية لذرة الكربون أنواع مختلفة
ايزومرية المركبات العضوية (القدرة على الايزومرية الضوئية
تبين أنها حاسمة في التطور الكيميائي الحيوي للأحماض الأمينية والكربوهيدرات و
بعض القلويدات).
وفقا لفرضية A.I.Oparin، فإن المركبات العضوية الأولى على الأرض
كانت من أصل حيوي. وكانت مصادر الكربون (CH4) و
سيانيد الهيدروجين (HCN) الموجود في الغلاف الجوي البدائي للأرض. مع
ظهور الحياة كمصدر وحيد للكربون غير العضوي،
بسبب تكوين كل المواد العضوية في المحيط الحيوي
ثاني أكسيد الكربون (CO2) الموجود في الغلاف الجوي، وكذلك المذاب فيه
مياه طبيعية على شكل HCO3. أقوى آلية امتصاص
(استيعاب) الكربون (على شكل ثاني أكسيد الكربون) - عملية التمثيل الضوئي - تم تنفيذها
النباتات الخضراء في كل مكان. هناك المزيد على الأرض تطوريًا
طريقة قديمة لاستيعاب ثاني أكسيد الكربون عن طريق التخليق الكيميائي؛ في هذه الحالة
الكائنات الحية الدقيقة - لا تستخدم المواد الكيميائية الاصطناعية الطاقة المشعة للشمس، ولكن
طاقة الأكسدة مركبات غير عضوية. معظم الحيوانات
استهلاك الكربون مع الطعام على شكل مركبات عضوية جاهزة. في
اعتمادًا على طريقة استيعاب المركبات العضوية المقبولة
التمييز بين الكائنات ذاتية التغذية والكائنات غيرية التغذية. طلب
للتخليق الحيوي للبروتين والمواد المغذية الأخرى للكائنات الحية الدقيقة،
استخدام الهيدروكربونات كمصدر وحيد للكربون
يعتبر النفط من أهم المشاكل العلمية والتقنية الحديثة.
بالإضافة إلى نظائر الكربون المستقرة، فهو شائع في الطبيعة
المشع 14C (يحتوي جسم الإنسان على حوالي 0.1 ميكروكوري).
استخدام نظائر الكربون في المجالات البيولوجية والطبية
ويرتبط البحث بالعديد من الإنجازات الكبرى في دراسة التبادل
المواد ودورة الكربون في الطبيعة. لذا، باستخدام التأريخ بالكربون المشع
تم إثبات إمكانية تثبيت H14CO3 بواسطة النباتات والأنسجة
الحيوانات، تم تحديد تسلسل تفاعل التمثيل الضوئي ودراسته
استقلاب الأحماض الأمينية، ومسارات التخليق الحيوي للعديد من المواد البيولوجية
المركبات النشطة، وما إلى ذلك. وقد ساهم استخدام 14C في النجاح
البيولوجيا الجزيئية في دراسة آليات التخليق الحيوي للبروتين وانتقاله
معلومات وراثية. تحديد نشاط معين من 14C في
تسمح لنا البقايا العضوية المحتوية على الكربون بالحكم على عمرها،
والذي يستخدم في علم الحفريات وعلم الآثار.
مراجع.
1. أحمدوف ن.س. الكيمياء غير العضوية. كتاب مدرسي دليل للطلاب من الصفوف 8-9.
مدرسة من العمق دراسة الكيمياء. في جزأين - الجزء 1، الجزء 2، - الطبعة الثانية. -
م: التربية، 1990 – 208 ص.
2. أحمدوف ن.س. الكيمياء العامة وغير العضوية. كتاب مدرسي دليل للجامعات,
م: الثانوية العامة 1988 – 470 ص.
3. بابيتش إل.في.، باليزين إس.إيه.، جليكينا إف.بي.، زاك إي.جي. ورشة عمل حول
الكيمياء غير العضوية. كتاب مدرسي دليل الجامعات م: المدرسة العليا 1989-
300 ثانية.
4. باشلاق أ.ت. "ما الذي يمكن أن يشعله ثاني أكسيد الكربون"، ث. "الكيمياء في المدرسة"
1991، رقم 5، ص. 58.
أسود الكربون (GOST 7885-86) هو نوع من منتجات الكربون الصناعية، يستخدم بشكل رئيسي في إنتاج المطاط كمادة حشو تعزز خصائص أدائه المفيدة. وعلى عكس فحم الكوك والزفت، فهو يتكون بالكامل تقريبًا من الكربون ويشبه السخام في مظهره.
نطاق التطبيق
ويستخدم حوالي 70% من أسود الكربون المنتج في إنتاج الإطارات، و20% لإنتاج المنتجات المطاطية. ويستخدم أسود الكربون أيضًا في إنتاج الطلاء والورنيش وفي إنتاج أحبار الطباعة، حيث يعمل كصبغة سوداء.
مجال آخر للتطبيق هو إنتاج المواد البلاستيكية وأغلفة الكابلات. هنا يتم إضافة المنتج كحشو ولإضفاء خصائص خاصة على المنتجات. ويستخدم أسود الكربون أيضًا بكميات صغيرة في صناعات أخرى.

مميزة
أسود الكربون هو نتاج عملية تنطوي على أحدث التقنيات الهندسية، ونظرًا لنقاوته ومجموعة محددة بدقة من الخصائص الفيزيائية والكيميائية، فإنه ليس لديه أي شيء مشترك مع السخام الذي يتكون كمنتج ثانوي ملوث من احتراق الفحم. وزيت الوقود، أو من تشغيل محركات الاحتراق الداخلي غير المنظمة. وفقًا للتصنيف الدولي المقبول عمومًا، يُطلق على أسود الكربون اسم Carbon Black (الكربون الأسود المترجم من اللغة الإنجليزية) ، السخام باللغة الإنجليزية - السخام. أي أن هذه المفاهيم لا يتم الخلط بينها بأي حال من الأحوال.
ولم يكن التأثير التعزيزي الناتج عن تعبئة المطاط بأسود الكربون أقل أهمية في تطور صناعة المطاط من اكتشاف ظاهرة الكبريت. في المخاليط المطاطية، يحتل الكربون الموجود في عدد كبير من المكونات المستخدمة المرتبة الثانية من حيث الوزن بعد المطاط. إن تأثير مؤشرات جودة أسود الكربون على خصائص المنتجات المطاطية أكبر بكثير من مؤشرات جودة المكون الرئيسي - المطاط.
تعزيز الخصائص
يُطلق على تحسين الخواص الفيزيائية للمادة عن طريق إدخال مادة حشو اسم التعزيز (التعزيز)، وتسمى هذه الحشوات معززات (أسود الكربون، أكسيد السيليكون المترسب). من بين جميع مكبرات الصوت، يتمتع أسود الكربون بخصائص فريدة حقًا. حتى قبل الفلكنة، فإنه يرتبط بالمطاط، ولا يمكن فصل هذا الخليط بالكامل إلى أسود الكربون والمطاط باستخدام المذيبات.
قوة المطاط المصنوع من أهم المطاط الصناعي:
المطاط الصناعي | قوة الشد، MPa |
|
مبركن غير مملوء | مبركن مملوء بالكربون الأسود |
|
مطاط ستايرين بوتادين | ||
مطاط النتريل بوتادين | ||
مطاط الإيثيلين والبروبيلين | ||
مطاط بولي اكريليت | ||
مطاط البولي بوتادين | ||
يوضح الجدول خصائص الفلكنة التي يتم الحصول عليها من أنواع مختلفة من المطاط بدون حشو ومملوءة بأسود الكربون. من خلال البيانات المقدمة، يمكن ملاحظة مدى تأثير الحشو بالكربون على قوة شد المطاط. بالمناسبة، المساحيق المشتتة الأخرى المستخدمة في مخاليط المطاط لإعطاء اللون المطلوب أو تقليل تكلفة الخليط - الطباشير والكاولين والتلك وأكسيد الحديد وغيرها ليس لها خصائص تقوية.
بناء
الكربون الطبيعي النقي هو الماس والجرافيت. لديهم بنية بلورية تختلف بشكل كبير عن بعضها البعض. التشابه في هيكل الجرافيت الطبيعي و مادة اصطناعيةأسود الكربون. تشكل ذرات الكربون في الجرافيت طبقات كبيرة من أنظمة عطرية مكثفة على شكل حلقة، بمسافة بين ذرية تبلغ 0.142 نانومتر. عادةً ما تسمى طبقات الجرافيت هذه من الأنظمة العطرية المكثفة بالمستويات القاعدية. المسافة بين الطائرات محددة بدقة وهي 0.335 نانومتر. تقع جميع الطبقات بالتوازي مع بعضها البعض. كثافة الجرافيت 2.26 جرام/سم3.
على عكس الجرافيت، الذي له ترتيب ثلاثي الأبعاد، يتميز الكربون التقني بترتيب ثنائي الأبعاد فقط. وهو يتألف من مستويات جرافيت متطورة تقع بشكل متوازي تقريبًا مع بعضها البعض، ولكن يتم إزاحتها فيما يتعلق بالطبقات المجاورة - أي أن المستويات موجهة بشكل تعسفي فيما يتعلق بالعادي.
تتم مقارنة هيكل الجرافيت مجازيًا بمجموعة أوراق مطوية بدقة، ويتم مقارنة هيكل أسود الكربون بمجموعة أوراق اللعب التي يتم فيها نقل البطاقات. المسافة بين الكواكب فيه أكبر من مسافة الجرافيت وتبلغ 0.350-0.365 نانومتر. لذلك، تكون كثافة أسود الكربون أقل وتتراوح بين 1.76-1.9 جم/سم3، اعتمادًا على العلامة التجارية (في أغلب الأحيان 1.8 جم/سم3).
تلوين
تُستخدم درجات الصبغ (اللون) من أسود الكربون في إنتاج أحبار الطباعة والطلاءات والبلاستيك والألياف والورق ومواد البناء. وهي مصنفة إلى:
- أسود الكربون شديد التلوين (HC) ؛
- تلطيخ المتوسطة (MS)؛
- تلطيخ عادي (RC) ؛
- لون منخفض (LC).
يشير الحرف الثالث إلى طريقة الإنتاج - الفرن (F) أو القناة (C). مثال على التعيين: HCF - أسود الكربون ذو اللون العالي للفرن (Hiqh Color Furnace).

ترتبط قدرة التلوين للمنتج بحجم جزيئاته. اعتمادًا على حجمها، ينقسم الكربون التقني إلى مجموعات:
تصنيف
ينقسم أسود الكربون للمطاط إلى:
- تقوية عالية (واقية، صلبة). تتميز بقوتها المتزايدة ومقاومتها للتآكل. حجم الجسيمات صغير (18-30 نانومتر). تستخدم في السيور الناقلة ومعالجتها للإطارات.
- شبه التسليح (الإطار، لينة). حجم الجسيمات متوسط (40-60 نانومتر). تستخدم في مختلف المنتجات المطاطية، وجثث الإطارات.
- مكاسب منخفضة. حجم الجسيمات كبير (أكثر من 60 نانومتر). استخدام محدود في صناعة الإطارات. يوفر القوة اللازمة مع الحفاظ على مرونة عالية في المنتجات المطاطية.
التصنيف الكامل لأسود الكربون موجود في معيار ASTM D1765-03، المقبول من قبل جميع الشركات المصنعة العالمية للمنتج ومستهلكيه. يتم فيه التصنيف، على وجه الخصوص، وفقًا لنطاق المساحة السطحية المحددة للجسيمات:
رقم المجموعة | متوسط المساحة السطحية النوعية لامتصاص النيتروجين م2/جم |
إنتاج الكربون الأسود
هناك ثلاث تقنيات لإنتاج أسود الكربون الصناعي، والتي تستخدم دورة الاحتراق غير الكامل للهيدروكربونات:
- موقد؛
- قناة؛
- خروف؛
- بلازما.
هناك أيضًا طريقة حرارية يتحلل فيها الأسيتيلين أو الأسيتيلين عند درجات حرارة عالية. الغاز الطبيعي.

العديد من الدرجات التي تم الحصول عليها من خلال تقنيات مختلفة لها خصائص متنوعة.
تكنولوجيا التصنيع
من الممكن نظرياً الحصول على أسود الكربون بجميع الطرق المذكورة أعلاه، لكن أكثر من 96% من المنتج المنتج يتم الحصول عليه بطريقة الفرن من مواد خام سائلة. تتيح هذه الطريقة الحصول على درجات مختلفة من أسود الكربون مع مجموعة محددة من الخصائص. على سبيل المثال، يتم إنتاج أكثر من 20 درجة من أسود الكربون باستخدام هذه التقنية باستخدام أسود الكربون.
التكنولوجيا العامة هي على النحو التالي. يتم تزويد المفاعل بالهواء المسخن إلى 800 درجة مئوية، والمبطن بمواد شديدة المقاومة للحرارة. بسبب احتراق الغاز الطبيعي، تتشكل منتجات الاحتراق الكاملة عند درجة حرارة 1820-1900 درجة مئوية، وتحتوي على كمية معينة من الأكسجين الحر. يتم حقن المواد الخام الهيدروكربونية السائلة، التي تم خلطها جيدًا مسبقًا وتسخينها إلى 200-300 درجة مئوية، في منتجات الاحتراق الكامل ذات درجة الحرارة العالية. يحدث الانحلال الحراري للمواد الخام عند درجة حرارة يتم التحكم فيها بشكل صارم، والتي، اعتمادًا على درجة أسود الكربون المنتج، لها قيم مختلفة من 1400 إلى 1750 درجة مئوية.
على مسافة معينة من نقطة توريد المواد الخام، يتم إيقاف التفاعل التأكسدي الحراري عن طريق حقن الماء. تشكلت نتيجة الانحلال الحراري أسود الكربونوتدخل غازات التفاعل إلى سخان الهواء، حيث تتخلى عن جزء من حرارتها للهواء المستخدم في العملية، بينما تنخفض درجة حرارة خليط غاز الكربون من 950-1000 درجة مئوية إلى 500-600 درجة مئوية.
بعد التبريد إلى 260-280 درجة مئوية بسبب الحقن الإضافي للمياه، يتم إرسال خليط أسود الكربون والغازات إلى كيس مرشح، حيث يتم فصل أسود الكربون عن الغازات ويدخل إلى قادوس المرشح. يتم إمداد أسود الكربون المنفصل من قادوس الفلتر عبر خط أنابيب نقل الغاز بواسطة مروحة (منفاخ توربيني) إلى قسم التحبيب.

الشركات المصنعة لأسود الكربون
إنتاج العالم من أسود الكربون يتجاوز 10 ملايين طن. يتم تفسير هذه الحاجة الكبيرة للمنتج في المقام الأول من خلال خصائصه التعزيزية الفريدة. القوى الدافعة لهذه الصناعة هي:
- Aditya Birla Group (الهند) - حوالي 15% من السوق.
- شركة كابوت (الولايات المتحدة الأمريكية) - 14% من السوق.
- أوريون للكربونات الهندسية (لوكسمبورغ) - 9%.
أكبر منتجي الكربون الروس:
- شركة Omsktekhuglerod LLC - 40٪ من السوق الروسية. المصانع في أومسك، فولغوغراد، موغيليف.
- OJSC "ياروسلافل الكربون الأسود" - 32٪.
- OJSC Nizhnekamsktekhuglerod - 17%.
